
【题目】698 K时,向V L的密闭容器中充入2 mol H2(g)和2 mol I2(g),发生反应:H2(g)+I2(g)2HI(g) ΔH=-26.5 kJ·mol-1,测得各物质的物质的量浓度与时间变化的关系如图所示。

请回答下列问题:
(1)V=________;反应从开始到平衡时,这段时间内平均反应速率v(HI)=_______。
(2)下列说法中可以说明反应2HI(g) H2(g)+I2(g)已达到平衡状态的是___。
A.单位时间内生成n mol H2的同时生成2n mol HI
B.温度和体积一定时,容器内压强不再变化
C.条件一定,混合气体的平均相对分子质量不再变化
D.温度和压强一定时,混合气体的密度不再变化
(3)当反应H2(g)+I2(g) 2HI(g)达到平衡状态时,_____(填“吸收”或“放出”)的热量为___。
(4)恒容下,某时刻加入HI(g),HI(g)的转化率_______(填“增大”、“减小”、“不变”)。
(5)压缩体积,平衡向________移动(填“正反应”、“逆反应”、“不”),气体颜色_______(填“变深”、“变浅”、不变”)
【答案】2 0.316mol·L-1·s-1 A 放出 41.87 kJ 不变 不 变深
【解析】
(1)开始时,通入H2的物质的量为2mol,根据图象,H2的物质的量浓度为1mol·L-1,则V=2L;根据化学反应速率的数学表达式,v(HI)=1.58mol/L÷5s=0.316mol/(L·s);
(2)A、生成H2,反应向正反应方向进行,生成HI,反应向逆反应方向进行,且生成H2的物质的量与生成HI的物质的量之比等于化学计量数之比,因此能说明反应达到平衡,故A符合题意;
B、反应前后气体系数之和相等,且温度一定,因此压强不变,不能说明反应达到平衡,故B不符合题意;
C、组分都是气体,气体总质量不变,反应前后气体系数之和相等,气体总物质的量不变,即摩尔质量不变,不能说明反应达到平衡,故C不符合题意;
D、容积定值,气体质量不变,因此密度不变,不能说明反应达到平衡,故D不符合题意,答案为A;
(3)正反应是放热反应,因此该反应达到平衡时放热,放出的热量为(1-0.21)mol/L×2L×26.5kJ/mol=41.87kJ;
(4)反应前后气体系数之和相等,恒容时,加入HI,与原平衡构成等效平衡,即HI的转化率不变;
(5)反应前后气体系数之和不变,压缩体积,压强增大,平衡不移动,容器的体积缩小,组分浓度变大,气体颜色变深。


科目:高中化学 来源: 题型:
【题目】NaC1O3可用于制取二氧化氯、亚氯酸钠及高氯酸盐等。以原盐(主要成分为NaC1)为原料制备氯酸钠的工艺流程如下:

已知:Cr2O72-+H2O![]() 2CrO42-+2H+。
2CrO42-+2H+。
回答下列问题:
(1)“粗制盐水”中加入NaOH和Na2CO3的目的是___________________。
(2)过滤时,使用的玻璃仪器有烧杯、玻璃棒和____________。
(3)在pH:6.4~6.8,温度:40~50℃的条件下电解,理论上最终产物只有NaC1O3。电解时阳极的产物为C12,溶液中发生的反应有C12+H2O====HC1O+H++C1-,HC1O![]() H++C1O-和__________。
H++C1O-和__________。
(4)电解槽中温度不宜过高,其原因是_________________________。加入的Na2Cr2O7可以调节电解液酸度,若酸度过大,则电解液中主要存在__________(填“Cr2O72-”或“CrO42-”)。
(5)为检测电解后盐水中NaC1O3的物质的量浓度进行下列实验:
I.准确吸取10.00mL电解后的盐水,加入适量的3%H2O2溶液充分搅拌并煮沸。
Ⅱ.准确吸取0.10mol·L-1的(NH4)2Fe(SO4)2标准溶液25.00 mL于300mL锥形瓶中,加入足量稀硫酸。
III.将I的溶液加入Ⅱ的锥形瓶中,隔绝空气煮沸10min,加热充分反应。冷却至室温后,加入10mL0.4mol·L-1MnSO4溶液、5mL 85%磷酸溶液,用c mol·L-1的KMnO4标准溶液滴定剩余的Fe2+至溶液变为微红色,即滴定终点,此时消耗高锰酸钾V mL。
①步骤I中加入H2O2溶液的作用是______________________。
②步骤Ⅱ中C1O3-被Fe2+还原为C1-的离子方程式为________________________。
③该盐水中NaC1O3的物质的量浓度为________mol·L-1。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】当不慎有大量Cl2扩散到周围空间时,处在环境中的人们可以用浸有一定浓度某种物 质水溶液的毛巾捂住鼻子,以防中毒,该物质最适宜采用的是
A.NaOHB.NaClC.NaHCO3D.NH3![]() H2O
H2O
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】呋喃(![]() )和吡咯(
)和吡咯(![]() )是较常见的杂环化合物呋喃通过下列反应可转化为吡咯:
)是较常见的杂环化合物呋喃通过下列反应可转化为吡咯:
![]()
回答下列问题:
(1)呋喃和吡咯所含元素中:电负性最大的是___________(填元素符号),第一电离能最大的元素的基态原子电子排布图是______________________。
(2)呋喃分子中,碳原子的杂化方式是___________,1mol吡咯分子中含________molσ键。
(3)NH3与H2O可与Zn2+形成配合物[Zn(NH3)3(H2O)]2+。与Zn2+形成配位键的原子是___________(填元素符号);H2O的空间构型为___________;写出一种与NH3互为等电子体的阳离子:___________(填化学式)。
(4)NH3的相对分子质量比N2O的小,但其沸点却比N2O的高,其主要原因是___________。
(5)ZnO晶体随着环境条件的改变能形成不同结构的晶体,其中一种的晶胞结构如图所示,已知该ZnO晶体密度为ag·cm-3,NA表示阿伏加德罗常数。则该晶体中与Zn2+等距离且最近的Zn2+共有___________个,该ZnO晶胞中相邻两个O2-之间的距离为___________nm。

查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列有机反应方程式书写正确的是
A. 甲烷与氯气的取代反应:CH4+Cl2![]() CH2Cl2+H2
CH2Cl2+H2
B. 苯与硝酸的硝化反应:![]() +HNO3
+HNO3![]()
![]() +H2O
+H2O
C. 乙醇的催化氧化反应:CH3CH2OH+O2![]() CH3CHO+H2O
CH3CHO+H2O
D. 乙酸与乙醇的酯化反应:CH3COOH+CH3CH2OH![]() CH3COOCH2CH3
CH3COOCH2CH3
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】化学与能源开发、环境保护、资源利用等密切相关。下列说法正确的是
A.垃圾是放错地方的资源,应分类回收利用
B.实现化石燃料清洁利用,就无需开发新能源
C.绿色化学的核心是应用化学原理对环境污染进行治理
D.为提高农作物的产量和质量,应大量使用化肥和农药
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下面有关晶体的叙述中,不正确的是 ( )
A. 氯化铯晶体中,每个Cs+周围紧邻8个Cl-
B. 金刚石为空间网状结构,由共价键形成的碳原子环中,最小的环上有6个碳原子
C. 干冰晶体中,每个CO2分子周围紧邻12个CO2分子
D. 金属铜属于六方最密堆积结构,金属镁属于面心立方最密堆积结构
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】工业生产尿素的原理是以NH3和CO2为原料合成尿素[CO(NH2) 2],反应的化学方程式为 2NH3(g)+ CO2 (g) CO(NH2) 2(l)+ H2O(l)+Q(Q>0)。该反应分两步进行:① 2NH3(g)+ CO2 (g) NH4COONH2 (s)+ Q1(Q1>0),② NH4COONH2 (s) CO(NH2) 2(l)+ H2O(l)+Q2 (Q2<0).
(1)固体CO2称干冰,属于___________晶体。氮原子最外层电子排布式是___________。
(2)氧元素的非金属性比碳强,用原子结构的知识说明理由_________________
(3)下列示意图中,能正确表示合成尿素过程中能量变化的是____________。
A、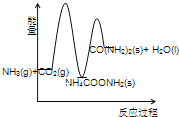 B、
B、
C、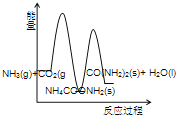 D、
D、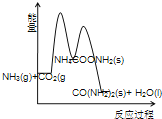
(4)写出合成尿素第一步反应的平衡常数表达式K=_________________________________。
(5)某实验小组模拟工业上合成尿素的条件,在恒定温度下,将氨气和二氧化碳按2:1的物质的量之比充入一体积为10L的密闭容器中(假设容器体积不变,生成物的体积忽略不计),经20min达到平衡,各物质浓度的变化曲线如图所示。
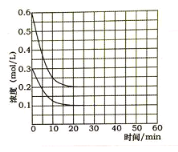
① 在上述条件下,从反应开始至20min时,二氧化碳的平均反应速率为___________。
② 为提高合成尿素的产率,下列可以采取的措施有____________。
a. 缩小反应容器的容积 b. 升高温度
c. 增加反应物的量 d. 使用合适的催化剂
③ 若保持平衡的温度和体积不变,25min 时再向容器中充入2mol氨气和1mol二氧化碳,在40min时重新达到平衡,请在下图中画出25~50min内氨气的浓度变化曲线____________。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com