
【题目】1799年,英国化学家汉弗莱·戴维发现了N2O气体。在食品行业中,N2O可用作发泡 剂和密封剂。
(l) N2是硝酸生产中氨催化氧化的副产物,NH3与O2在加热和催化剂的作用下生成N2O的化学方程式为________。
(2)N2O在金粉表面发生热分解反应:2N2O(g)=2N2(g)+O2(g)△H。
已知:2NH3(g)+3N2O(g)=4N2(g)+3H2O(l) △H1=-1010KJ/mol
4NH3(g)+3O2(g) =2N2(g)+6H2O(l) △H2=-1531KJ/mol
△H=__________。
(3)N2O和CO是环境污染性气体,研究表明,CO与N2O在Fe+作用下发生反应:N2O(g)+CO(g)![]() CO2(g)十N2(g)的能量变化及反应历程如下图所示,两步反应分别为:反应①Fe++N2O
CO2(g)十N2(g)的能量变化及反应历程如下图所示,两步反应分别为:反应①Fe++N2O![]() FeO+N2;反应②______________
FeO+N2;反应②______________
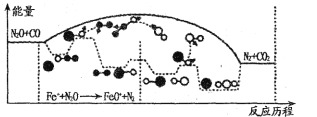
由图可知两步反应均为____(填“放热”或“吸热”)反应,由______(填“反应①或反应②”)决定反应达到平衡所用时间。
(4)在固定体积的密闭容器中,发生反应:N2O(g)+CO(g)![]() CO2(g)+N2(g),改变原料气配比进行多组实验(各次实验的温度可能相同,也可能不同),测定N2O的平衡转化率。部分实验结果如图所示:
CO2(g)+N2(g),改变原料气配比进行多组实验(各次实验的温度可能相同,也可能不同),测定N2O的平衡转化率。部分实验结果如图所示:
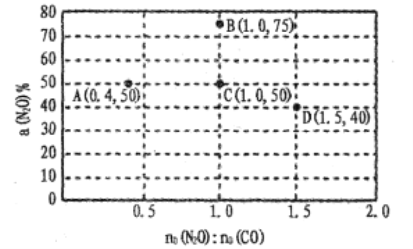
①如果要将图中C点的平衡状态改变为B点的平衡状态,应采取的措施是:____ ;
②图中C、D两点对应的实验温度分别为TC和TD,,通过计算判断TC____TD(填“>”“=”或“<”)。
(5)在某温度下,向1L密闭容器中充入CO与N2O,发生反应:N2O(g)+CO(g)![]() CO2(g)十N2(g),随着反应的进行,容器内CO的物质的量分数变化如下表所示:
CO2(g)十N2(g),随着反应的进行,容器内CO的物质的量分数变化如下表所示:
时间/min | 0 | 2 | 4 | 6 | 8 | 10 |
物质的量分数 | 50.0% | 40.25% | 32.0% | 26.2% | 24.0% | 24.0% |
则该温度下反应的平衡常数K=____。
【答案】2NH3+2O2![]() N2O+3H2O -163kJ/mol FeO++CO
N2O+3H2O -163kJ/mol FeO++CO![]() CO2+Fe+ 放热 反应① 降低温度 = 1.17
CO2+Fe+ 放热 反应① 降低温度 = 1.17
【解析】
(2)利用盖斯定律求反应热;
(3)根据总反应减去反应①得到反应②;根据反应物和生成物的相对能量判断反应热;根据活化能的相对大小判断化学反应速率大小,从而确定决速步;
(4)根据不同温度下的平衡常数的大小,判断温度的变化;
(5)根据三等式求算平衡常数。
(1)NH3和O2反应得到N2O,根据化合价升降守恒配平,NH3中N的化合价从-3升高到N2O中的+1,共升高4价;O2中O的化合价从0降低到-2,共降低4价,化合价升降守恒,则NH3和O2的系数比为1:1,根据原子守恒配平,可得2NH3+2O2![]() N2O+3H2O;
N2O+3H2O;
(2) 已知①2NH3(g)+3N2O(g)=4N2(g)+3H2O(l) △H1=-1010KJ/mol,②4NH3(g)+3O2(g) =2N2(g)+6H2O(l) △H2=-1531KJ/mol;反应①×![]() -反应②×
-反应②×![]() 可得目标反应,则△H=△H1×
可得目标反应,则△H=△H1×![]() -△H2×
-△H2×![]() =-1010kJ/mol×
=-1010kJ/mol×![]() -(-1531kJ/mol)×
-(-1531kJ/mol)×![]() =-163kJ/mol;
=-163kJ/mol;
(3)总反应为N2O(g)+CO(g)![]() CO2(g)十N2(g),实际过程是分2步进行,因此反应①和反应②相加得到总反应,则反应②等于总反应减去反应①,可得反应②为FeO++CO
CO2(g)十N2(g),实际过程是分2步进行,因此反应①和反应②相加得到总反应,则反应②等于总反应减去反应①,可得反应②为FeO++CO![]() CO2+Fe+;
CO2+Fe+;
根据反应历程图可知,反应物的总能量大于生成物的总能量,则该两步反应均为放热反应;
根据反应①的历程图可知,由Fe+和N2O经过过渡态得到产物FeO+和N2,过渡态和反应物Fe+和N2O的能量差为反应①的活化能,同理,可知反应②的活化能,可知,反应①的活化能大于反应②的活化能,活化能越大,化学反应速率越慢,而化学反应速率慢的步骤为决速步,决定反应达到平衡所用时间,即反应①决定反应达到平衡所用时间;
(4)①根据图像,C点和B点,反应物的投料比相同,但是B点表示的平衡状态,N2O的转化率高于C点,C点的平衡状态改变为B点的平衡状态,平衡正向移动,N2O的转化率增加;B和C点的反应物投料比相同,因此不是改变反应物的浓度;反应前后的气体体积不变,因此压强不影响平衡移动,只能是温度,该反应为放热反应,平衡正向移动,因此采取的措施是降低温度;
①利用三等式求出C和D点平衡状态的平衡常数,从而比较温度大小;
设定容器体积的体积为VL。
C点的平衡状态其反应物的投标比为1,则设N2O和CO的物质的量均为1mol,其N2O的转化率为0.50,则根据三等式有
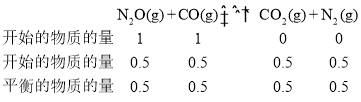 ,则在平衡常数
,则在平衡常数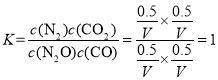 ;
;
D点的平衡状态其反应物的投标比为1.5,则设N2O和CO的物质的量为1.5mol和1mol,其N2O的转化率为0.40,N2O反应了1.5mol×0.40=0.6mol,则根据三等式有
 ,则在平衡常数
,则在平衡常数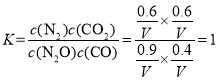 ;
;
C点和D点表示的平衡状态的平衡常数相同,则温度相同,有TC=TD;
(5)根据表格的数据,开始时CO的物质的量分数为50.0%,则设CO和N2O的物质的量各位1mol,假设到达平衡时,CO转化了xmol,根据三等式有
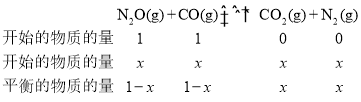 ,达到平衡时,CO的物质的量分数为24.0%,则有
,达到平衡时,CO的物质的量分数为24.0%,则有![]() ,解得x=0.52mol,则平衡常数
,解得x=0.52mol,则平衡常数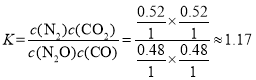 。
。


科目:高中化学 来源: 题型:
【题目】已知:①CO(g)+H2O(g)=CO2(g)+H2(g) ΔH1 ②CH4(g)+H2O(g)=CO(g)+3H2(g) ΔH2 下列推断正确的是( )
A.若CO的燃烧热为ΔH3,则H2的燃烧热为ΔH3-ΔH1
B.反应CH4(g)+CO2(g)=2CO(g)+2H2(g)的ΔH=ΔH1-ΔH2
C.若反应②的反应物总能量低于生成物总能量,则ΔH2<0
D.若等物质的量的CO和H2完全燃烧生成气态产物时前者放热更多,则ΔH1<0
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某同学设计如图所示装置探究氯气能否与水发生反应。已知气体a的主要成分是含有少量水蒸气的氯气。请回答下列问题:
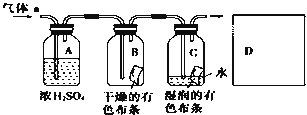
(1)浓硫酸的作用是_____________________________________。
(2)写出实验室制取Cl2的化学方程式_______________________________。
(3)证明氯气和水发生反应的实验现象为___________________________。
(4)该实验设计存在的缺陷是________,为了克服该缺陷,需要补充装置D,其中发生反应的离子方程式为_____________________________________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】常温下,下列各组离子在指定溶液中一定能大量共存的是( )
A.0.1mol·L-1 KNO3溶液:Mg2+、Fe3+、Cl-、![]()
B.无色透明的溶液:Cu2+、![]() 、
、![]() 、
、![]()
C.使pH试纸变红的溶液:K+、Ca2+、Cl-、ClO-
D.水电离出的c(H+)=10-12mol·L-1的溶液:Na+、![]() 、
、![]() 、
、![]()
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】按要求回答下列问题:
(1)键线式![]() 的系统命名为 __________________;
的系统命名为 __________________;
(2) 中含有的官能团为_______________;
中含有的官能团为_______________;
(3)2-甲基-1-丁烯的结构简式____________________;
(4)相对分子质量为 72 且一氯代物只有一种的烷烃的结构简式________________;
(5)分子式为 C2H6O 的有机物,有两种同分异构体,乙醇(CH3CH2OH)、甲醚(CH3OCH3),则通过下列方法,不可能将二者区别开来的是________________;
A.红外光谱 B.核磁共振氢谱 C.质谱法 D.与钠反应
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】已知![]() 互为同分异构体,下列说法不正确的是
互为同分异构体,下列说法不正确的是
A. z的二氯代物有三种
B. x、y的一氯代物均只有三种
C. x、y、z中只有x的所有原子可能处于同一平面
D. x、y 可使溴的四氯化碳溶液因发生加成反应而褪色
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】已知钠、铁都能与水反应,下列叙述不正确的是( )
A.它们反应的难易程度不同B.它们反应的产物不完全相同
C.都需在高温条件下进行D.反应类型都是置换反应
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】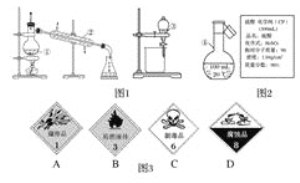
(1)写出图1中序号①~④仪器的名称:①__;②__;③__;④__。在仪器①~④中,使用前必须检查是否漏水的有__(填仪器序号)。
(2)图2是某学校实验室从化学试剂商店买回的浓硫酸试剂标签上(密度1.84 g·cm-3,质量分数98%)的部分内容,现用该浓硫酸配制480 mL 1 mol·L﹣1的稀硫酸。可供选用的仪器有:
①胶头滴管;②烧瓶;③烧杯;④药匙;⑤量筒;⑥托盘天平。
请回答下列问题:
a.图3中盛放浓硫酸的试剂瓶标签上应该印有图警示标记中的__(写标记代号A~D)。
b.配制稀硫酸时,除了上述仪器,还缺少的仪器有__、__(写仪器名称)。
c.经计算,配制480 mL 1 mol·L-1的稀硫酸,需要用量筒量取上述浓硫酸的体积为__mL(保留一位小数点)。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】光刻胶是大规模集成电路、印刷电路版和激光制版技术中的关键材料,某一光刻胶M的合成路线如下: (部分试剂、反应条件和产物已略去)
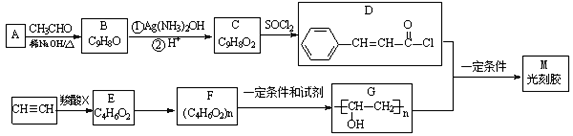
已知:
Ⅰ.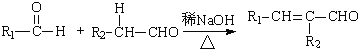 (R1,R2为烃基或氢)
(R1,R2为烃基或氢)
Ⅱ.![]() (R1,R2为烃基)
(R1,R2为烃基)
(1)写出A的结构简式______,B分子中的含氧官能团的名称为_______________。
(2)写出B与银氨溶液发生反应的化学方程式____________________________________。
(3)下列有关光刻胶M的说法正确的是______________________(填字母序号)。
a.可稳定存在于碱性溶液中
b.化学式为C11H10O2
c.可发生氧化反应、还原反应、取代反应
d. 1mol该物质与足量H2发生加成反应时可消耗4mol H2
(4)乙炔和羧酸X发生加成反应生成E,E的核磁共振氢谱有三组峰,且峰面积比为3:2:1, E能使溴水褪色且能发生水解反应,则F的结构简式为________________________。
(5)与C具有相同官能团且含有苯环的同分异构体还有______种(不考虑立体异构);C的另一种同分异构体满足下列条件:①能发生银镜反应和水解反应,其水解产物之一能与FeCl3溶液发生显色反应②苯环上的一氯取代产物只有两种,写出该同分异构体的结构简式:_________。
(6)根据已有知识并结合相关信息,写出以CH3CHO为原料制备CH3CH2CH2COOH的合成路线流程图_______________________(无机试剂任意选用),合成路线流程图示例如下: CH3CH2Br![]() CH3CH2OH
CH3CH2OH![]() CH3COOCH2CH3
CH3COOCH2CH3
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com