
| A. | [Cl-]>[NH4+]>[H+]>[OH-] | B. | [NH4+]>[Cl-]>[OH-]>[H+] | C. | [Cl-]>[NH4+]>[OH-]=[H+] | D. | [Cl-]=[NH4+]>[H+]>[OH-] |
 快乐5加2金卷系列答案
快乐5加2金卷系列答案科目:高中化学 来源: 题型:选择题
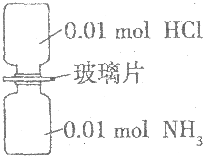 室温下,抽去如图所示装置中的玻璃片,使两种气体充分反应.下列说法正确的是(设NA表示阿伏加德罗常数的数值)( )
室温下,抽去如图所示装置中的玻璃片,使两种气体充分反应.下列说法正确的是(设NA表示阿伏加德罗常数的数值)( )| A. | 装置中氢元素的总质量为0.04g | |
| B. | 气体生成物的总体积为0.448 L | |
| C. | 生成物中含有0.01NA个分子 | |
| D. | 生成物完全溶于水后所得溶液含有0.01NA个NH4Cl |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
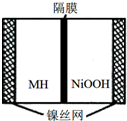 如图是在航天用高压氢镍电池基础上发展起来的一种金属氢化物镍电池(MH-Ni电池),该电池放电时总反应为:NiOOH+MH═Ni(OH)2+M,下列有关说法中不正确的是( )
如图是在航天用高压氢镍电池基础上发展起来的一种金属氢化物镍电池(MH-Ni电池),该电池放电时总反应为:NiOOH+MH═Ni(OH)2+M,下列有关说法中不正确的是( )| A. | 放电时正极反应为:NiOOH+H2O+e-═Ni(OH)2+OH- | |
| B. | 电池的电解液可为KOH溶液 | |
| C. | 充电时负极反应为:MH+OH-+e-═H2O+M | |
| D. | MH是一类储氢材料,其氢密度越大,电池的能量密度越高 |
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
 维生素C是一种水溶性维生素(其水溶液呈酸性),它的分子式是C6H8O6.人体缺乏这种维生素易得坏血症,所以维生素C又称抗坏血酸.维生素C易被空气中的氧气氧化.在新鲜水果、蔬菜、乳制品中都含维生素C,如新鲜橙汁中维生素C的含量在500mg•L-1左右.某校课外活动小组测定了某品牌的软包装橙汁中维生素C的含量.下面是测定实验分析报告,请填写有关空白.
维生素C是一种水溶性维生素(其水溶液呈酸性),它的分子式是C6H8O6.人体缺乏这种维生素易得坏血症,所以维生素C又称抗坏血酸.维生素C易被空气中的氧气氧化.在新鲜水果、蔬菜、乳制品中都含维生素C,如新鲜橙汁中维生素C的含量在500mg•L-1左右.某校课外活动小组测定了某品牌的软包装橙汁中维生素C的含量.下面是测定实验分析报告,请填写有关空白.| 实验序号 | 1 | 2 | 3 | 4 |
| 消耗NaOH溶液的体积(mL) | 20.05 | 20.00 | 18.80 | 19.95 |
查看答案和解析>>
科目:高中化学 来源: 题型:多选题
| A. | 废旧显示器必须回收,其主要目的是为了提取其中的贵重金属 | |
| B. | 生活污水中所含的氮、磷化合物是植物营养素,但会导致水体污染 | |
| C. | 二氧化碳和甲烷等会导致“温室效应”,从而引起全球变暖 | |
| D. | 雾霾天气会造成严重的交通问题,雾霾是一种胶体 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | R的氢化物比Y的氢化物的沸点更高 | |
| B. | X与Z组成的化合物溶于水呈碱性 | |
| C. | 只有Y元素存在同素异形体 | |
| D. | X、Y、Z、R形成简单离子的半径依次增大 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
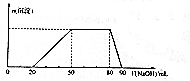 某50 mL溶液中可能含有H+、Na+、NH4+、Mg2+、Al3+、SO42-等离子,当向该溶液中加入5 mol•L-1NaOH溶液时,发现生成沉淀的物质的量n(沉淀)随NaOH溶液的体积V(NaOH)变化关系如图所示.下列说法正确的是( )
某50 mL溶液中可能含有H+、Na+、NH4+、Mg2+、Al3+、SO42-等离子,当向该溶液中加入5 mol•L-1NaOH溶液时,发现生成沉淀的物质的量n(沉淀)随NaOH溶液的体积V(NaOH)变化关系如图所示.下列说法正确的是( )| A. | 原溶液中一定存在Mg2+、Al3+、H+、SO42- | |
| B. | 原溶液中Al3+的浓度为1mol•L-1 | |
| C. | 原溶液中NH4+的物质的量为0.4mol | |
| D. | 当加入的NaOH的溶液的体积为90mL时,反应后溶液中的离子只有Na+和SO42- |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 酸性:HNO3>H2CO3>H2SiO3 | B. | 稳定性;H2S>H2O>HF | ||
| C. | 还原性:Cl->Br->I- | D. | 碱性:NaOH>Mg(OH)2>Ca(OH)2 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com