
| 族 周期 | ⅠA | ⅡA | ⅢA | ⅣA | ⅤA | ⅥA | ⅦA | 0 |
2 | ① | ② | ③ | |||||
3 | ④ | ⑤ | ⑥ | ⑦ | ⑧ | ⑨ | ||
4 | ⑩ | ? |
 ,故答案为:Ar;
,故答案为:Ar; ;
; ,
, ;
;
| ||
| ||


 津桥教育计算小状元系列答案
津桥教育计算小状元系列答案科目:高中化学 来源: 题型:
| Ⅰ | Ⅱ | Ⅲ | Ⅳ | Ⅴ | Ⅵ | Ⅶ | 0 | |
| 2 | ① | ② | ③ | ④ | ||||
| 3 | ⑤ | ⑥ | ⑦ | |||||
| 4 | ⑧ | ⑨ | ⑩ |
查看答案和解析>>
科目:高中化学 来源: 题型:
查看答案和解析>>
科目:高中化学 来源: 题型:

查看答案和解析>>
科目:高中化学 来源: 题型:
查看答案和解析>>
科目:高中化学 来源: 题型:
 (1)铝可将水中的NO3-转化为N2,从而消除污染.该反应中涉及的粒子有:H2O、Al、AlO2-、Al(OH)3、NO3-、N2,请将这些粒子中除NO3-以外的粒子填入以下空格内(要配平)
(1)铝可将水中的NO3-转化为N2,从而消除污染.该反应中涉及的粒子有:H2O、Al、AlO2-、Al(OH)3、NO3-、N2,请将这些粒子中除NO3-以外的粒子填入以下空格内(要配平)查看答案和解析>>
科目:高中化学 来源: 题型:

查看答案和解析>>
科目:高中化学 来源: 题型:
| A、R原子的电子层数比N的电子层数多1 |
| B、RO3-中R的化合价与NO3-中N化合价不等 |
| C、RO3-和NO3-只能被还原,不能被氧化 |
| D、R与N为同族元素 |
查看答案和解析>>
科目:高中化学 来源: 题型:
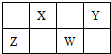
| A、非金属性:W>Z |
| B、原子半径:X<Y |
| C、Z的最高价氧化物可溶于Y的氢化物的水溶液 |
| D、Y的最高价氧化的水化物酸性强于W最高价氧化的水化物 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com