

���� ��1��NO��CO��Ӧ��������Ⱦ���壬������ӦΪ��2NO+2CO=N2+2CO2����ͼ��֪��1mol NO2��1mol CO��Ӧ����CO2��NO�ų�����368-134=234kJ����Ӧ�Ȼ�ѧ����ʽΪ��NO2��g��+CO��g��=NO��g��+CO2��g����H=-234 kJ•mol-1�������֪�Ȼ�ѧ����ʽ�����ø�˹������дĿ���Ȼ�ѧ����ʽ��
��2������ͼ��֪��8minʱ���������ʵ���Ϊ2mol���μӷ�Ӧ������Ϊ8mol-2mol=6mol������v=$\frac{��c}{��t}$����v��H2��������������֮�ȵ����仯ѧ������֮�ȼ���v��CO2����
�ڻ�ѧƽ�ⳣ������ָ��һ���¶��£����淴Ӧ�ﵽƽ��ʱ��������Ũ�ȵĻ�ѧ���������ݵij˻����Ը���Ӧ��Ũ�ȵĻ�ѧ���������ݵij˻����õı�ֵ��ע����塢��Һ�岻��Ҫд����
������I��Ӧ��������ת�������������ʵ����٣��ı�����ƽ�����淴Ӧ�����ƶ��������������¶ȣ���÷�Ӧ���ȣ������¶�ƽ�������ƶ���
���ߢ�Ӧ��������ת�������������ʵ����࣬ƽ�������ƶ�������������ѹǿ��
ƽ�ⳣ��ֻ���¶ȵ�Ӱ�죬�÷�Ӧ���ȣ������¶�ƽ�������ƶ���ƽ�ⳣ����С��
��3����Ӧ�����ǣ�SO2+O2+H2O=H2SO4����������������Ӧ�����������ڸ���ʧȥ������ˮ����������������ӣ�
��� �⣺��1��NO��CO��Ӧ��������Ⱦ���壬������ӦΪ��2 NO+2 CO=N2+2 CO2��
��֪����N2��g��+O2��g��=2NO ��g����H=179.5kJ•mol-1
��2NO ��g��+O2��g��=2NO2��g����H=-112.3kJ•mol-1
��ͼ��֪��1mol NO2��1mol CO��Ӧ����CO2��NO�ų�����368-134=234kJ���÷�Ӧ�Ȼ�ѧ����ʽΪ��NO2��g��+CO��g��=NO��g��+CO2��g����H=-234 kJ•mol-1��
���ݸ�˹���ɿ�֪���ۡ�2+��-�ٵã�2 NO ��g��+2 CO ��g��=N2��g��+2 CO2��g����H=-759.8 kJ•mol-1��
�ʴ�Ϊ��2 NO ��g��+2 CO ��g��=N2��g��+2 CO2��g����H=-759.8 kJ•mol-1��
��2������ͼ��֪��8minʱ���������ʵ���Ϊ2mol���μӷ�Ӧ������Ϊ8mol-2mol=6mol����v��H2��=$\frac{\frac{6mol}{2L}}{8min}$=0.375mol/��L•min��������֮�ȵ��ڻ�ѧ������֮�ȣ���v��CO2��=$\frac{1}{3}$v��H2��=$\frac{1}{3}$��0.375mol/��L•min��=0.125mol/��L•min����
�ʴ�Ϊ��0.125��
�ڷ�ӦCO2��g��+3H2��g��?CH3OH��g��+H2O��g����ƽ�ⳣ������ʽK=$\frac{c��C{H}_{3}OH��•c��{H}_{2}O��}{c��C{O}_{2}��•{c}^{3}��{H}_{2}��}$��
�ʴ�Ϊ��$\frac{c��C{H}_{3}OH��•c��{H}_{2}O��}{c��C{O}_{2}��•{c}^{3}��{H}_{2}��}$��
������I��Ӧ��������ת�������������ʵ����٣������������¶ȣ���÷�Ӧ���ȣ������¶�ƽ�������ƶ���������������ת����
���ߢ�Ӧ��������ת�������������ʵ����࣬������ѹǿƽ�������ƶ�����Ӧ������ѹǿ��
ƽ�ⳣ��ֻ���¶ȵ�Ӱ�죬�÷�Ӧ���ȣ������¶�ƽ�������ƶ���ƽ�ⳣ����С�����¶�Խ��ƽ�ⳣ��ԽС�����ߢ��¶���ߣ���K1��K��
�ʴ�Ϊ�����£���ѹ��K1��K��
��3����Ӧ����ΪSO2+O2+H2O=H2SO4����������������Ӧ�����������ڸ���ʧȥ������ˮ����������������ӣ������缫��ӦʽΪSO2-2e-+2H2O=4H++SO42-��
�ʴ�Ϊ��SO2-2e-+2H2O=4H++SO42-��
���� ���⿼���Ϊ�ۺϣ��漰�Ȼ�ѧ����ʽ��д����ѧ��Ӧ���ʼ��㡢��ѧƽ�ⳣ������ѧƽ��ͼ��ԭ��ص�֪ʶ����ȷ��ѧƽ�⼰��Ӱ��Ϊ���ؼ���ע�����ջ�ѧ��Ӧ���ʡ���ѧƽ�ⳣ���ĸ������ʽ������������ѧ���ķ�����������������ѧ����������


 ��������һ���þ�ϵ�д�
��������һ���þ�ϵ�д� Сѧ��10����Ӧ����ϵ�д�
Сѧ��10����Ӧ����ϵ�д�
| �꼶 | ���пγ� | �꼶 | ���пγ� |
| ��һ | ��һ��ѿγ��Ƽ��� | ��һ | ��һ��ѿγ��Ƽ��� |
| �߶� | �߶���ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
| ���� | ������ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
��Ŀ�����л�ѧ ��Դ�� ���ͣ������
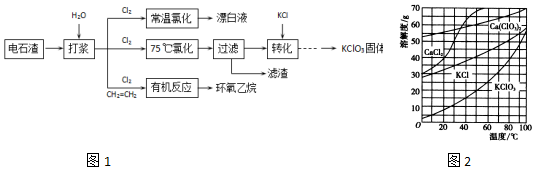
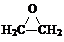 +CaCl2+H2O��
+CaCl2+H2O���鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�ѡ����
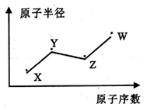 X��Y��Z��W�����ֳ������Ķ���������Ԫ�أ���ԭ�Ӱ뾶��ԭ�������ı仯��ͼ��ʾ����֪Y��Z����Ԫ�صĵ����ǿ�������Ҫ�ɷ֣�Wԭ�ӵ�������������Neԭ�ӵ��������������1������˵����ȷ���ǣ�������
X��Y��Z��W�����ֳ������Ķ���������Ԫ�أ���ԭ�Ӱ뾶��ԭ�������ı仯��ͼ��ʾ����֪Y��Z����Ԫ�صĵ����ǿ�������Ҫ�ɷ֣�Wԭ�ӵ�������������Neԭ�ӵ��������������1������˵����ȷ���ǣ�������| A�� | Y��Z��W����ͬһ���� | B�� | Y��W������⻯�������Ӧ | ||
| C�� | �ǽ����ԣ�Z��Y | D�� | X��Z��W�γɵĻ������Ϊǿ�� |
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�ѡ����
| A�� | HR��Һ�еμ���ɫʯ����Һ����Һ���ɫ | |
| B�� | ����ʱ��NaR��Һ��pH����7 | |
| C�� | HR��Һ��������NaR���壬�ܽ����Һ��pH��� | |
| D�� | ����ʱ��0.01 mol•L-1��HR��ҺpH=4 |
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�ѡ����
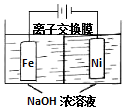 ���й㷺��;��Na2FeO4���õ�ⷨ��ȡ��Fe+2H2O+2OH-$\frac{\underline{\;ͨ��\;}}{\;}$FeO42-+3H2�����乤��ԭ����ͼ��ʾ������������ȷ���ǣ�������
���й㷺��;��Na2FeO4���õ�ⷨ��ȡ��Fe+2H2O+2OH-$\frac{\underline{\;ͨ��\;}}{\;}$FeO42-+3H2�����乤��ԭ����ͼ��ʾ������������ȷ���ǣ�������| A�� | ���һ��ʱ��������ҵ�c��OH-������ | |
| B�� | Na+������������������ | |
| C�� | ������Ӧʽ��2H2O+2e-=H2��+2OH- | |
| D�� | �������У�������1 mol OH-ʱ��ͬʱ����33.6 L H2 |
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ������
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ���ѡ��
| A�� | 3mol C+1mol D | |
| B�� | 1mol A+0.5mol B+1.5mol C+0.5mol D | |
| C�� | 1mol A+0.5mol B+1.5mol C | |
| D�� | 4mol A+2mol B |
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ������
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ������
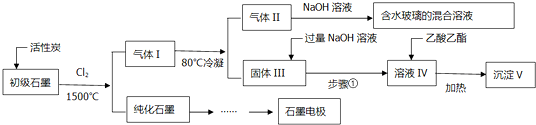
�鿴�𰸺ͽ���>>
����ʡ������Υ���Ͳ�����Ϣ�ٱ�ƽ̨ | �����к���Ϣ�ٱ�ר�� | ����թƭ�ٱ�ר�� | ����ʷ���������к���Ϣ�ٱ�ר�� | ������Ȩ�ٱ�ר��
Υ���Ͳ�����Ϣ�ٱ��绰��027-86699610 �ٱ����䣺58377363@163.com