
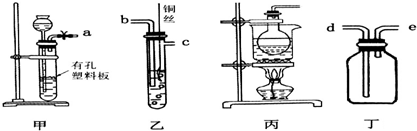
分析 (1)NO易与空气中的氧气反应,用CO2排尽装置中的空气;Cu与稀硝酸反应生成NO;
(2)①KClO3和草酸(H2C2O4)在酸性条件下反应生成ClO2、CO2和KHSO4,发生氧化还原反应,结合质量守恒可书写化学方程式,结合方程式判断氧化产物和还原产物的物质的量之比;
②温度低于100℃的水浴加热应用温度计控制温度;
③硫酸钡难溶于盐酸,即反应生成硫酸钡,据此书写离子反应方程式即可.
解答 解:(1)选用甲、乙、丁制备、收集一氧化氮气体,甲中塑料板上若放置石灰石,丁中盛满稀NaOH溶液,利用排液法收集,短口进气,丁为收集装置,由于NO易与空气中的氧气反应,用CO2排尽装置中的空气,则甲中塑料板上放置大理石与硝酸反应生成CO2;Cu与稀硝酸反应生成NO、硝酸铜和水,则反应的离子方程式为:3Cu+8H++2NO3-═3Cu2++2NO↑+4H2O,装置的连接顺序为a、b、c、e,
故答案为:a、b、c、e;利用碳酸钙与盐酸产生的CO2排尽装置中的空气;3Cu+8H++2NO3-═3Cu2++2NO↑+4H2O;
(2)①KClO3和草酸(H2C2O4)在酸性条件下反应生成ClO2、CO2和KHSO4,反应的方程式为2KClO3+H2C2O4+2H2SO4$\frac{\underline{\;\;△\;\;}}{\;}$2ClO2↑+2CO2↑+2KHSO4+2H2O,氧化产物为CO2,还原产物为ClO2,二者物质的量之比为1:1;
故答案为:1:1;
②温度低于100℃的水浴加热应用温度计控制温度,所以丙装置中缺少的一种必需的玻璃仪器名称是温度计;
故答案为:温度计;
③将二氧化氯溶液加入到硫化氢溶液中,加入少量的稀盐酸酸化过的氯化钡溶液,发现有白色沉淀生成,因为硫酸钡难溶于盐酸,所以白色沉淀为BaSO4,离子反应方程式为:5H2S+8ClO2+4H2O=18H++5SO42-+8Cl-,故答案为:5H2S+8ClO2+4H2O=18H++5SO42-+8Cl-.
点评 本题考查制备实验方案的评价,为高频考点,把握物质的制备实验、实验技能及实验装置的作用为解答的关键,侧重分析与实验能力的考查,注意实验的评价性分析,题目难度不大.


科目:高中化学 来源: 题型:选择题
| A. | 向亚磷酸溶液中加入过量的烧碱溶液(亚磷酸是二元弱酸):H3PO3+3OH-═PO33-+3H2O | |
| B. | 2mol•L-1的AlCl3溶液和7mol•L-1的NaOH溶液等体积混合:2Al3++7OH-═Al(OH)3↓+AlO${\;}_{2}^{-}$+2H2O | |
| C. | 用硝酸酸化的硝酸铁溶液可以刻蚀银饰:Fe3++Ag═Fe2++Ag+ | |
| D. | H218O中投入Na2O2固体:2H218O+2Na2O2═4Na++4OH-+18O2 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
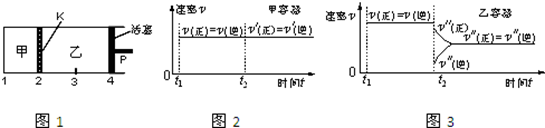
| A. | 保持温度和活塞位置不变,在甲中再加入1 mol A和2 mol B,达到新的平衡后,甲中C的浓度是乙中 C的浓度的2倍 | |
| B. | 保持活塞位置不变,升高温度,达到新的平衡后,甲、乙中B的体积分数均增加 | |
| C. | 保持温度不变,移动活塞P,使乙的容积和甲相等,达到新的平衡后,乙中C的体积分数是甲中C的体积分数的2倍 | |
| D. | 保持温度和乙中的压强不变,t2时分别向甲、乙中加入等质量的氦气后,甲、乙中反应速率变化情况分别如图2和图3所示(t1前的反应速率变化已省略) |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | ①②③④⑤ | B. | ②③④⑥⑦ | C. | ②③⑤⑥⑦ | D. | ①②⑤⑥⑦ |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 与水反应 | B. | 与氢氧化钠溶液反应 | ||
| C. | 与硫酸反应 | D. | 与前三种物质均能反应 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 铁与硫酸铜溶液反应:Fe+Cu2+═Cu+Fe 3+ | |
| B. | 铜与稀硝酸反应:Cu+4H++2NO3-═Cu2++2NO2↑+2H2O | |
| C. | 铝与氢氧化钠溶液反应:2Al+2OH-+2H2O═2AlO2-+3H2↑ | |
| D. | 氢氧化钡溶液与稀硫酸反应:Ba2++SO42-+H++OH-═BaSO4↓+H2O |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 上述实验中不能用盐酸代替硫酸 | |
| B. | 将试管充分振荡后静置,溶液颜色变为紫色 | |
| C. | 在酸性条件下,PbO2的氧化性比MnO4-的氧化性强 | |
| D. | 若硫酸锰充分反应,消耗PbO2的物质的量为0.01mol |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com