
 室温时,盐酸和硫酸的混合溶液20mL,向混合物中逐滴加入0.05mol•L-1Ba(OH)2溶液时,生成的BaSO4和pH的变化如图所示(不考虑溶液混合时体积的变化).下列说法正确的是( )
室温时,盐酸和硫酸的混合溶液20mL,向混合物中逐滴加入0.05mol•L-1Ba(OH)2溶液时,生成的BaSO4和pH的变化如图所示(不考虑溶液混合时体积的变化).下列说法正确的是( )| A. | 图中A点对应溶液的pH:a=1 | |
| B. | 生成沉淀的最大质量m=2.33g | |
| C. | 原混合液中c(HCl)=0.1mol•L-1 | |
| D. | 当V[Ba(OH)2(aq)]=30mL时,有关离子浓度大小:c(Cl-)>c(Ba2+)>c(H+) |
分析 由图可知,加入20mLBa(OH)2溶液时,硫酸钡沉淀达最大值,故0~20mL只有硫酸与氢氧化钡反应,而盐酸未反应,根据方程式计算硫酸、硫酸钡的物质的量,根据m=nM计算硫酸钡的质量;
由图可知,pH=7时,消耗60mLBa(OH)2溶液,由H++OH-═H2O可知n(H+)=n(OH-),据此计算原溶液中含有的n(H+),进而计算原溶液中n(HCl),再根据c=$\frac{n}{V}$计算原溶液中盐酸的物质的量浓度,图中A点盐酸未反应,计算混合后氢离子的浓度,根据pH=-lgc(H+)计算.
解答 解:由图可知,加入20mLBa(OH)2溶液时,硫酸钡沉淀达最大值,只有硫酸与氢氧化钡反应,而盐酸未反应,此时加入氢氧化钡的物质的量=0.02L×0.05mol•L-1=0.001mol,则:
H2SO4+Ba(OH)2═BaSO4↓+H2O
1 1 1
0.001mol 0.001mol 0.001mol
由图可知,pH=7时,消耗60mLBa(OH)2溶液,此时加入氢氧化钡的物质的量=0.06L×0.05mol•L-1=0.003mol,由H++OH-═H2O可知原溶液中含有的n(H+)=n(OH-)=0.003mol×2=0.006mol,故n(HCl)=0.006mol-0.001mol×2=0.004mol,
A.硫酸与Ba(OH)2发生反应:H2SO4+Ba(OH)2=BaSO4↓+2H2O,当沉淀完全时,n(H2SO4)=n(Ba(OH)2)=0.05mol•L-1×0.02L=1.0×10-3mol,由于溶液显中性时消耗Ba(OH)2的体积是60ml,所以HCl的物质的量是n(HCl)=2 n(Ba(OH)2)=2×0.05mol•L-1×0.04L=4.0×10-3mol,所以在a点时溶液的c(H+)=$\frac{4.0×1{0}^{-3}mol}{0.04L}$=0.1mol/L,所以pH=1,故A正确;
B.生成沉淀的最大质量m(BaSO4)=1.0×10-3mol×233g/mol=0.233g,故B错误;
C.原混合液中c(HCl)=$\frac{n(HCl)}{V}$=$\frac{4.0×1{0}^{-3}mol}{0.02L}$=0.2mol•L-1,故C错误;
D.当V[Ba(OH)2(aq)]=30mL时,n(Cl-)=4.0×10-3mol,n(Ba2+)=0.05mol•L-1×0.01L=1.0×10-4 mol;n(H+)=4.0×10-3mol-2×0.05mol•L-1×0.01L=3.0×10-3mol.在同一溶液中,微粒的物质的量越大,则其物质的量浓度就越大,所以有关离子浓度大小:c(Cl-)>c(H+)>c(Ba2+),故D错误;
故选A.
点评 本题考查酸的混合溶液与碱反应时溶液的体积与溶液的酸碱性、微粒浓度的大小及沉淀的关系的知识,掌握基础是关键,题目难度中等.


 期末好成绩系列答案
期末好成绩系列答案 99加1领先期末特训卷系列答案
99加1领先期末特训卷系列答案 百强名校期末冲刺100分系列答案
百强名校期末冲刺100分系列答案 好成绩1加1期末冲刺100分系列答案
好成绩1加1期末冲刺100分系列答案 金状元绩优好卷系列答案
金状元绩优好卷系列答案科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. |  制备和收集氧气的实验装置 | |
| B. |  蒸馏海水的实验装置 | |
| C. | 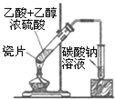 导气管插入碳酸钠溶液液面下可防止乙酸乙酯挥发 | |
| D. |  制取氢氧化亚铁时能观察到白色沉淀 |
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 用结晶法除去硝酸钾中的氯化钠杂质 | |
| B. | 用蒸馏法分离苯和溴苯 | |
| C. | 用分液法分离水和酒精 | |
| D. | 用饱和NaHCO3溶液除去CO2中混有的少量HCl气体 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | PH3分子中有未成键的孤对电子 | B. | PH3是非极性分子 | ||
| C. | 它的分子构型是平面三角形 | D. | 磷原子采用sp2杂化方式 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. |  实验室制乙烯 | |
| B. | 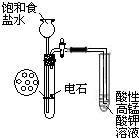 实验室制乙炔并验证乙炔发生氧化反应 | |
| C. | 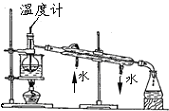 实验室中分馏石油 | |
| D. | 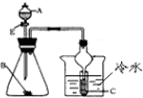 若A为稀硫酸、B为碳酸钠(粉状)、C为苯酚钠溶液,验证稀硫酸、苯酚、碳酸酸性的强弱 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
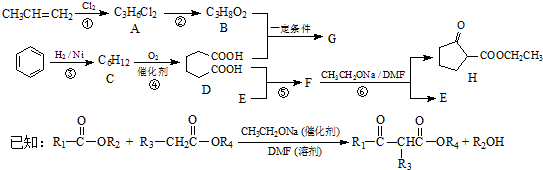
 .
.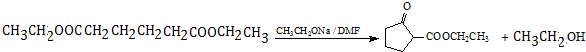 .
.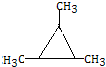 .
.查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com