
| A. | 应研发新型高效催化剂以提高合成氨工业中氨的产率 | |
| B. | 糖尿病患者不能食用含糖类的物质 | |
| C. | 空气中NO和NO,等氮氧化物含量过高可导致光化学烟雾或酸雨的形成 | |
| D. | “84”消毒液与漂白粉溶液的有效成分均是Ca( ClO)2,均具有消毒杀菌能力 |
分析 A.催化剂不改变化学平衡;
B.糖尿病人血糖和尿糖的含量都较高,应少吃含糖的食品;
C.形成光化学烟雾和酸雨的重要原因是氮的氧化物;
D.“84”消毒液的有效成分是NaClO,漂白粉的有效成分是Ca(ClO)2.
解答 解:A.催化剂不改变化学平衡,所以研发高效催化剂,不能提高合成氨工业中氨的产率,故A错误;
B.糖尿病人血糖和尿糖的含量都较高,应少吃含糖的食品,不可以多吃,故B错误;
C.以NO和NO2为主的氮氧化物是形成光化学烟雾和酸雨的一个重要原因,故C正确;
D.氯气与NaOH溶液制备“84”消毒液,其有效成分是NaClO,而氯气与石灰乳制备漂白粉,其有效成分是Ca(ClO)2,故D错误;
故选C.
点评 本题考查知识点较多,为小综合,涉及平衡移动、酸雨、氯气的性质等,侧重物质性质的考查,题目难度中等.


科目:高中化学 来源: 题型:选择题
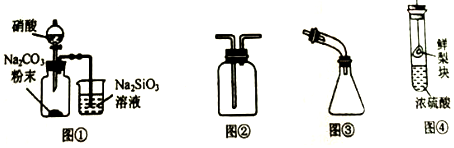
| A. | 图①:证明非金属性由强到弱的顺序是N>C>Si | |
| B. | 图②:收集NO2或NH3 | |
| C. | 图③:海水蒸馏时接收蒸馏水 | |
| D. | 图④:探究浓硫酸的脱水性 |
查看答案和解析>>
科目:高中化学 来源: 题型:实验题
 (1)溶液的pH除了可以通过实验得出的具体数据计算得到,在实验室中还可以用pH试纸或pH计来测量得到.
(1)溶液的pH除了可以通过实验得出的具体数据计算得到,在实验室中还可以用pH试纸或pH计来测量得到.| 滴定次数 | 待测液体积(mL)[来源 | 标准盐酸体积(mL) | |
| 滴定前读数(mL) | 滴定后读数(mL) | ||
| 第一次 | 25.00 | 0.50 | 20.40 |
| 第二次 | 25.00 | 4.00 | 24.10 |
查看答案和解析>>
科目:高中化学 来源: 题型:实验题
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
查看答案和解析>>
科目:高中化学 来源: 题型:实验题
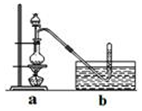 CH3Cl为无色,略带臭味的气体,密度为2.25g/L,熔点为-24.2℃,不易溶于水,易溶于乙醇和丙醇等有机溶剂.
CH3Cl为无色,略带臭味的气体,密度为2.25g/L,熔点为-24.2℃,不易溶于水,易溶于乙醇和丙醇等有机溶剂.| 滴定次数 | 1 | 2 | 3 | 4 |
| 消耗KMnO4溶液体积/mL | 20.90 | 20.02 | 20.00 | 19.98 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com