
 X、Y、Z、W是中学化学常见的四种物质,它们之间具有如图所示转化关系,则下列组合不可能的是:
X、Y、Z、W是中学化学常见的四种物质,它们之间具有如图所示转化关系,则下列组合不可能的是:| X | Y | Z | W | |
| A | NaOH | Na2CO3 | NaHCO3 | CO2 |
| B | O2 | CO2 | CO | C |
| C | AlCl3 | Al(OH)3 | NaAlO2 | NaOH |
| D | S | SO2 | SO3 | O2 |
| A. | A | B. | B | C. | C | D. | D |
分析 A.NaOH可与少量二氧化碳反应生成Na2CO3,也可与过量二氧化碳生成NaHCO3,Na2CO3也可与CO2反应NaHCO3;
B.C可与氧气反应生成CO,也可生成二氧化碳,二氧化碳可与C反应一氧化碳;
C.氯化铝可与氢氧化钠反应分别生成Al(OH)3、NaAlO2,Al(OH)3可与继续反应生成NaAlO2;
D.硫和氧气反应只生成二氧化硫.
解答 解:A.NaOH可与少量二氧化碳反应生成Na2CO3,也可与过量二氧化碳生成NaHCO3,Na2CO3也可与CO2反应NaHCO3,符合转化关系,故A不选;
B.氧气不足时,C和氧气反应生成CO,氧气过量时,生成CO2,二氧化碳可与C反应一氧化碳,符合转化关系,故B不选;
C.氯化铝可与少量氢氧化钠反应生成Al(OH)3,与过量氢氧化钠反应生成NaAlO2,Al(OH)3可与继续反应生成NaAlO2,符合转化关系,故C不选;
D.硫和氧气反应只生成二氧化硫,不能生成三氧化硫,故D选.
故选D.
点评 本题考查无机物的推断,侧重于物质的性质的考查,注意物质的性质,学习中注意相关基础知识的积累,题难度不大.


 阅读快车系列答案
阅读快车系列答案科目:高中化学 来源: 题型:选择题
| A. | 铝片与稀盐酸的反应 | B. | Ca(OH)2与NH4Cl的反应 | ||
| C. | 灼热的炭与CO2的反应 | D. | 甲烷在氧气中的燃烧反应 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题

 H2SiO3↓+2OH-(或者SiO32-+3H2O
H2SiO3↓+2OH-(或者SiO32-+3H2O H4SiO4↓+2OH-)(用离子方程式表示).
H4SiO4↓+2OH-)(用离子方程式表示).查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 质子数为92、中子数为146的U原子:${\;}_{92}^{146}$U | |
| B. | HClO的结构式:H-Cl-O | |
| C. | HF的电子式: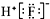 | |
| D. | 35Cl-和37Cl-离子结构示意图均可以表示为: |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 129C60中含有NA个电子 | |
| B. | 46g NO2和N2O4的混合气体含有的原子数为3NA | |
| C. | 标准状况下,22.4L CCl4所含的分子数为6.02×1023 | |
| D. | 100mL0.1mol/LCaCl2溶液中Cl-的物质的量浓度为0.01mol/L |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题

查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com