
判断正误,正确的划“√”,错误的划“×”
(1)同周期元素,从左到右,原子半径逐渐减小,离子半径也逐渐减小( )
(2)电子层数越多,半径越大( )
(3)在主族元素中,最高正化合价均等于主族序数( )
(4)元素的原子得电子越多,非金属性越强;失电子越多,金属性越强( )
(5)元素的氧化物对应的水化物酸性越强,非金属性越强;碱性越强,金属性越强( )
(6)元素的气态氢化物越稳定,非金属性越强,其水溶液的酸性越强,还原性越弱( )
(7)在Mg、Al、NaOH溶液构成的原电池中,因为Al作负极,Mg作正极,所以Al的金属性大于Mg( )
科目:高中化学 来源: 题型:
原子形成化合物时,电子云间的相互作用对物质的结构和性质会产生影响。请回答下列问题:
(1)BF3分子的立体结构为______________,NF3分子的立体结构为____________。
(2)碳原子有4个价电子,在形成化合物时价电子均参与成键,但杂化方式不一定相同。在乙烷、乙烯、乙炔和苯四种分子中,碳原子采取sp杂化的分子是____________(写结构简式,下同),采取sp2杂化的分子是__________,采取sp3杂化的分子是____________。试写出一种有机物分子的结构简式,要求同时含有三种不同杂化方式的碳原子:________________________________________________________________________。
(3)已知H2O、NH3、CH4三种分子中,键角由大到小的顺序是CH4>NH3>H2O,请分析可能的原因是________________________________________________。
(4)由于电荷的作用,阴、阳离子形成化合物时离子的电子云会发生变化,使离子键逐渐向共价键过渡。阳离子电荷数越多,阴离子半径越大时,电子云变化越大,导致所形成的化合物在水中的溶解度越小。由此可知,四种卤化银(AgF、AgCl、AgBr和AgI)在水中的溶解度由大到小的顺序为________________________________________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
中科院国家纳米科学中心2013年11月22日宣布,该中心科研人员在国际上首次“拍”到氢键的“照片”,实现了氢键的实空间成像,为“氢键的本质”这一化学界争论了80多年的问题提供了直观证据。这不仅将人类对微观世界的认识向前推进了一大步,也为在分子、原子尺度上的研究提供了更精确的方法。下列说法中正确的是( )
A.正是氢键的存在,冰能浮在水面上
B.氢键是自然界中最重要、存在最广泛的化学键之一
C.由于氢键的存在,沸点:HCl>HBr>HI>HF
D.由于氢键的存在,水分子中氢氧键角是104.5°
查看答案和解析>>
科目:高中化学 来源: 题型:
某航空站安装了一台燃料电池,该电池可同时提供电和水蒸气。所用燃料为氢气,电解质为熔融的碳酸钾。已知该电池的总反应为2H2+O2===2H2O,正极反应为O2+2CO2+4e-===2CO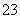 ,则下列推断正确的是 ( )。
,则下列推断正确的是 ( )。
A.负极反应为H2+2OH--2e-===2H2O
B.该电池可在常温或高温时进行工作,对环境具有较强的适应性
C.该电池供应2 mol水蒸气,同时转移2 mol电子
D.放电时负极有CO2生成
查看答案和解析>>
科目:高中化学 来源: 题型:
下面的虚线框中每一列、每一行相当于元素周期表的每一族和每一周期,但它的列数和行数都多于元素周期表。请在下面的虚线框中用实线画出元素周期表第1至第6周期的轮廓,并画出金属与非金属的分界线和第Ⅷ族的轮廓。

查看答案和解析>>
科目:高中化学 来源: 题型:
用“元素符号”填空(前20号元素)
(1)主族序数与周期数相同的元素有________。
(2)主族序数是周期数2倍的元素有________,3倍的元素有________。
(3)周期数是主族序数2倍的元素有________,3倍的元素有________。
查看答案和解析>>
科目:高中化学 来源: 题型:
铅是碳的同族元素,比碳多4个电子层。铅在元素周期表的位置为第________周期第________族;PbO2的酸性比CO2的酸性________(填“强”或“弱”)。
查看答案和解析>>
科目:高中化学 来源: 题型:
下表为元素周期表的一部分,请回答下列有关问题:
| ⅠA | ⅡA | ⅢA | ⅣA | ⅤA | ⅥA | ⅦA | 0 | |
| 2 | ① | ② | ||||||
| 3 | ③ | ④ | ⑤ | ⑥ | ⑦ | ⑧ | ||
| 4 | ⑨ | ⑩ |
(1)⑤和⑧的元素符号是________和________。
(2)表中最活泼的金属是________,非金属性最强的元素是________(填写元素符号)。
(3)表中能形成两性氢氧化物的元素是________,分别写出该元素的氢氧化物与⑥、⑨的最高价氧化物对应水化物反应的化学方程式:________________________,______________________________。
(4)请设计一个实验方案,比较⑦、⑩单质氧化性的强弱:
___________________________________________________________________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
已知扎那米韦是流感病毒神经氨酸酶抑制剂,其对流感病毒的抑制是以缓慢结合的方式进行的,具有高度特异性,其分子结构如下所示。

下列说法正确的是( )
A.该物质的分子式为C12H20N4O7
B.1 mol该物质与NaOH溶液反应,可以消耗4 mol NaOH
C.在一定条件下,该物质可以发生消去、加成、取代等反应
D.该物质能使溴水或酸性高锰酸钾溶液褪色,能与FeCl3溶液发生显色反应
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com