
【题目】氮和氮的化合物在工农业生产、国防和生活中都有极其广泛的用途。请回答下列与氮元素有关的问题:
(1)亚硝酸氯(结构式为Cl-N=O)是有机合成中的重要试剂,可由Cl2和NO在一定条件下通过以下反应制得:2NO+Cl2=2ClNO,已知几种化学键的键能数据如下表所示:
化学键 | Cl-Cl | Cl-N | N=O | N=O(NO) |
键能(kJ·mol-1) | 243 | a | 607 | 630 |
请根据表中数据计算:2NO(g)+Cl2(g)=2ClNO(g)△H=___kJmol-1。
(2)温度一定时,在一个体积为1L的密闭容器中通入2molNO和1molCl2,10min时ClNO体积占气体总体积40%(气体的“体积分数”即“物质的量分数”),则反应开始到10min内NO的平均反应速率:v(NO)=___mol·L-1·min-1
(3)以NH3为还原剂在脱硝装置中消除烟气中的氮氧化物,
主反应为4NH3(g)+4NO(g)+O2(g)=4N2(g)+6H2O(g) △H1
副反应:4NH3(g)+3O2(g)=2N2(g)+6H2O(g) △H2=-1267.1kJ/mol
4NH3(g)+5O2(g)=4NO(g)+6H2O(g) △H3=-907.3kJ/mol
①△H1=___。
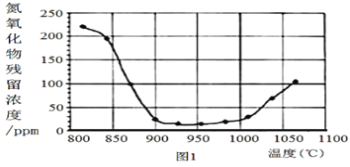
②将烟气按一定的流速通过脱硝装置,测得出口NO的浓度与温度的关系如图1,试分析脱硝的适宜温度是___(填序号)
a.<850℃ b.900~1000℃ c.>1050℃
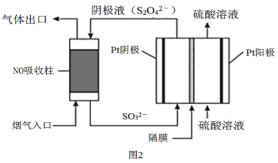
(4)以连二亚硫酸盐(S2O42-)为还原剂脱除烟气中的NO,并通过电解再生,装置如图2。阴极的电极反应式为___。
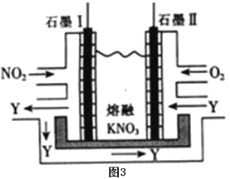
(5)利用电化学原理,将NO2、O2和熔融KNO3制成燃料电池,装置如图3所示,电池工作时,NO2转变成绿色硝化剂Y(N2O5),可循环使用,则石墨Ⅰ附近发生的电极反应式为:___。
【答案】289-2a 0.1 -1626.9kJ/mol b 2SO32-+2e-+4H+=S2O42-+2H2O NO2-e-+NO3-=N2O5
【解析】
(1)根据焓变等于反应物键能总和-生成物键能总和;
(2)根据速率公式进行计算;
(3)根据盖斯定律分析解答;
(4)根据电解原理,阴极发生还原反应得电子书写电极反应式;
(5)根据原电池工作原理,正极发生还原反应得电子书写电极反应式;
(1) 根据表中数据计算:2NO(g)+Cl2(g)=2ClNO(g)△H=![]() +243-
+243-![]() (607+a)= 289-2akJmol-1,故答案:289-2a;
(607+a)= 289-2akJmol-1,故答案:289-2a;
(2) 设氯气的变化量为x
2NO(g) + C12(g) = 2C1NO(g)
起始(mol/L) 2 1 0
变化(mol/L) 2x x 2x
10min (mol/L) 2-2x 1-x 2x
10min时CINO体积分时=![]() 100%=40%,解得x=1,v(NO)=
100%=40%,解得x=1,v(NO)=![]() =0.1mol·L-1·min-1;
=0.1mol·L-1·min-1;
故答案:0.1;
(3)①由已知副反应:②4NH3(g)+3O2(g)=2N2(g)+6H2O(g) △H2=-1267.1kJ/mol
③4NH3(g)+5O2(g)=4NO(g)+6H2O(g) △H3=-907.3kJ/mol;根据盖斯定律②![]() 2-③得:①4NH3(g)+4NO(g)+O2(g)=4N2(g)+6H2O(g),所以△H1=(-1267.1kJ/mol )
2-③得:①4NH3(g)+4NO(g)+O2(g)=4N2(g)+6H2O(g),所以△H1=(-1267.1kJ/mol )![]() 2-(-907.3kJ/mol)= -1626.9kJ/mol;
2-(-907.3kJ/mol)= -1626.9kJ/mol;
故答案:-1626.9kJ/mol;
②由浓度与温度的关系如图1可知,当温度在900~1000℃时,氮氧化物残留浓度较低,所以脱硝的适宜温度是900~1000℃,故b正确;
故答案:b;
(4)由图可知,阴极液的成分为S2O42-,在阴极上SO32-得电子生成S2O42-,所以阴极的电极反应式为2SO32-+2e-+4H+=S2O42-+2H2O;
故答案:2SO32-+2e-+4H+=S2O42-+2H2O;
(5)由已知将NO2、O2和熔融KNO3制成燃料电池,NO2转变成绿色硝化剂Y(N2O5)可知,石墨Ⅰ附近是NO2失电子生成N2O5,其电极反应的电极反应式为:NO2-e-+NO3-=N2O5;
故答案:NO2-e-+NO3-=N2O5。


 津桥教育计算小状元系列答案
津桥教育计算小状元系列答案科目:高中化学 来源: 题型:
【题目】钴、铁、镓、砷的单质及其化合物在生产生活中有重要的应用。回答下列问题:
(1)写出 As 的基态原子的电子排布式_____。
(2)将 NaNO3 和 Na2O 在一定条件下反应得到一种白色晶体,已知其中阴离子与 SO42-互为等 电子体,则该阴离子的化学式是_____。
(3)Fe3+、Co3+与 N3-、CN-等可形成络合离子。
①K3[Fe(CN)6]可用于检验 Fe2+,配体 CN-中碳原子杂化轨道类型为_____。
②[Co(N3)(NH3)5]SO4 中 Co 的配位数为_____,其配离子中含有的化学键类型为___(填离子键、共价键、配位键)。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】一定条件下,在体积为3 L的密闭容器中,一氧化碳与氢气反应生成甲醇(催化剂为Cu2O/ZnO):CO(g)+2H2(g)CH3OH(g)。
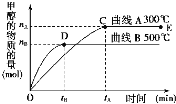
根据题意完成下列各题:
(1)反应达到平衡时,平衡常数表达式K=__________,升高温度,K值__________(填“增大”、“减小”或“不变”)。
(2)在500℃,从反应开始到平衡,氢气的平均反应速率v(H2)=______________。
(3)在其他条件不变的情况下,对处于E点的体系体积压缩到原来的1/2,下列有关该体系的说法正确的是__________(填字母序号)。
a.氢气的浓度减小 b.正反应速率加快,逆反应速率也加快
c.甲醇的物质的量增加 d.重新平衡时n(H2)/n(CH3OH)增大
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】t℃时,向20.00mL0.1mol/L二元弱酸H2X溶液中滴入0.1mol/LNaOH溶液,溶液中由水电离出的c水(OH-)的负对数[-lgc 水(OH-)]与所加NaOH溶液体积的关系如图所示。下列说法中不正确的是
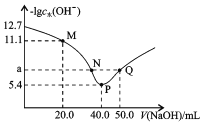
A.M点溶液中:c(Na+)>c(HX-)>c(H2X)
B.P点溶液中: c(OH-)-c(H+)=c(HX-)+2c(H2X)
C.溶液中![]()
D.水的电离程度:P>N=Q>M,且a=7
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】对甲基苯胺可用对硝基甲苯作原料在一定条件制得。 主要反应及装置如下:
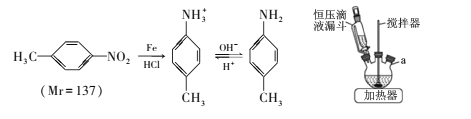
主要反应物和产物的物理性质见下表:
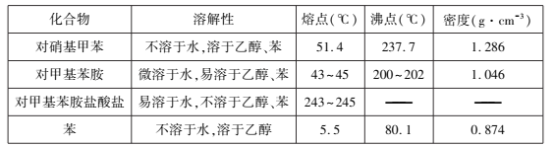
实验步骤如下:
①向三颈烧瓶中加入50mL稀盐酸、10.7mL(13.7g)对硝基甲苯和适量铁粉,维持瓶内温度在80℃左右,同时搅拌回流、使其充分反应;
②调节pH=7~8,再逐滴加入30mL苯充分混合;
③抽滤得到固体,将滤液静置、分液得液体M;
④向M中滴加盐酸,振荡、静置、分液,向下层液体中加入NaOH溶液,充分振荡、静置;
⑤抽滤得固体,将其洗涤、干燥得6.1g产品。
回答下列问题:
(1)主要反应装置如上图,a处缺少的装置是____ (填仪器名称),实验步骤③和④的分液操作中使用到下列仪器中的_____(填标号)。
a.烧杯 b.漏斗 c.玻璃棒 d.铁架台
(2)步骤②中用5%的碳酸钠溶液调pH =7~8的目的之一是使Fe3+ 转化为氢氧化铁沉淀,另一个目的是 ____。
(3)步骤③中液体M是分液时的____ 层(填“上”或“下”)液体,加入盐酸的作用是____。
(4)步骤④中加入氢氧化钠溶液后发生反应的离子方程式有____。
(5)步骤⑤中,以下洗涤剂中最合适的是____ (填标号)。
a.乙醇 b.蒸馏水 c.HCl溶液 d.NaOH溶液
(6)本实验的产率是_____%。(计算结果保留一位小数)
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】元素![]() 、
、![]() 、
、![]() 在周期表中的相对位置如图所示。已知
在周期表中的相对位置如图所示。已知![]() 元素原子的外围电子排布式为
元素原子的外围电子排布式为![]() ,则下列说法不正确的是( )
,则下列说法不正确的是( )
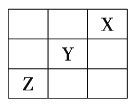
A.![]() 元素原子的价电子排布式为
元素原子的价电子排布式为![]()
B.![]() 元素在元素周期表的第三周期第ⅥA族
元素在元素周期表的第三周期第ⅥA族
C.![]() 元素所在周期中所含非金属元素最多
元素所在周期中所含非金属元素最多
D.![]() 元素原子的核外电子排布式为
元素原子的核外电子排布式为![]()
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】氧化白藜芦醇W具有抗病毒等作用。下面是利用Heck反应合成W的一种方法:
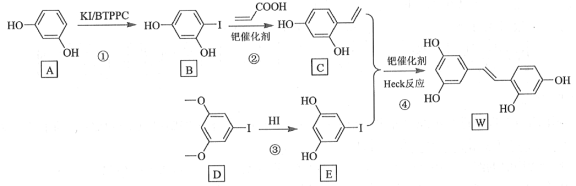
回答下列问题:
(1)A的化学名称为___________。
(2)![]() 中的官能团名称是___________。
中的官能团名称是___________。
(3)反应③的类型为___________,W的分子式为___________。
(4)不同条件对反应④产率的影响见下表:
实验 | 碱 | 溶剂 | 催化剂 | 产率/% |
1 | KOH | DMF | Pd(OAc)2 | 22.3 |
2 | K2CO3 | DMF | Pd(OAc)2 | 10.5 |
3 | Et3N | DMF | Pd(OAc)2 | 12.4 |
4 | 六氢吡啶 | DMF | Pd(OAc)2 | 31.2 |
5 | 六氢吡啶 | DMA | Pd(OAc)2 | 38.6 |
6 | 六氢吡啶 | NMP | Pd(OAc)2 | 24.5 |
上述实验探究了________和________对反应产率的影响。此外,还可以进一步探究________等对反应产率的影响。
(5)X为D的同分异构体,写出满足如下条件的X的结构简式________________。
①含有苯环;②有三种不同化学环境的氢,个数比为6∶2∶1;③1 mol的X与足量金属Na反应可生成2 g H2。
(6)利用Heck反应,由苯和溴乙烷为原料制备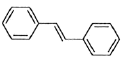 ,写出合成路线________________。(无机试剂任选)
,写出合成路线________________。(无机试剂任选)
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】.下表是从实验中测得的不同物质中氧氧键的键长和键能数据:
氧氧键 |
|
|
|
|
键长 | 149 | 128 | 121 | 112 |
键能 |
|
|
|
|
其中![]() 、
、![]() 的值尚未测定,但可根据规律推导
的值尚未测定,但可根据规律推导![]() 、
、![]() 、
、![]() 、
、![]() 的大小顺序是
的大小顺序是![]() ,该规律是( )
,该规律是( )
A.成键时,电子数越多,键能越大
B.键长越短,键能越大
C.成键所用电子数越少,键能越大
D.成键时电子对越偏移,键能越大
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】钡在氧气中燃烧时得到一种钡的氧化物晶体,结构如图所示,有关说法不正确的是( )

A. 该晶体属于离子晶体
B. 晶体的化学式为Ba2O2
C. 该晶体晶胞结构与NaCl相似
D. 与每个Ba2+距离相等且最近的Ba2+共有12个
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com