
【题目】钠、铝和铁是三种重要的金属。请回答:
(1)当前,产量最高,用途最广的金属是_____________。
(2)这三种金属的金属活动性由强到弱的顺序是_______________ 。
(3)硫酸铁有净水的作用。写出硫酸铁的电离方程式:_____________ 。
(4)小块金属钠投入水中,发生反应的化学方程式为_____________;可观察到的实验现象是_____(填字母)。
a.钠沉到水底 b.钠熔成小球 c.小球四处游动d.水变红色
(5)足量的铝与氢氧化钠溶液反应后得到标准状况下的氢气2.24L,则参加反应的铝的质量为_____ 。
【答案】铁 钠>铝>铁 Fe2(SO4)3=2Fe3++3SO42- 2Na+2H2O=2NaOH+H2↑ bc 1.8g
【解析】
(1)当前,产量最高,用途最广的金属是铁。
(2)按照金属活动性顺序表,这三种金属的金属活动性由强到弱的顺序是钠>铝>铁。
(3)硫酸铁在水中能电离出的Fe3+发生水解生成Fe(OH)3胶体,能吸附水中的杂质,有净水的作用。硫酸铁的电离方程式为Fe2(SO4)3=2Fe3++3SO42-。
(4)金属钠投入水中,生成NaOH和氢气,发生反应的化学方程式为2Na+2H2O=2NaOH+H2↑;钠比水轻,会浮在水面上,钠和水反应放出大量的热,同时由于钠的熔点低,所以可观察到钠熔成一个闪亮的小球,生成的氢气使小球四处游动,并伴随有嘶嘶的响声,没有向水中滴酚酞,所以不能观察到溶液变红,故选bc。
(5)根据铝和氢氧化钠溶液反应的化学方程式:
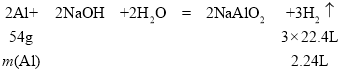
m(Al)=1.8g。


科目:高中化学 来源: 题型:
【题目】根据下图所示的实验,回答问题:
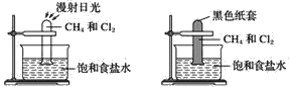
(1)装置A中的实验现象是____________________装置B中的实验现象是____
(2)根据上述实验,你能得出的结论是________________________________
(3)写出上述实验A中反应的化学方程式:
____________________________________________________;
____________________________________________________;
___________________________________________________;
______________________________________________________。
(4)上述反应的反应类型是________________________
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】BMO(Bi2MoO6)是一种高效光催化剂,可用于光催化降解苯酚,反应原理如下图所示。下列说法错误的是
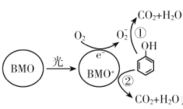
A.苯酚被氧化的总反应:C6H5OH+7O2![]() 6CO2+3H2O
6CO2+3H2O
B.反应过程中BMO表现较强氧化性
C.在酸性条件下,反应①的离子方程式是3C6H5OH+28![]() +28H+=l8CO2↑+23H2O
+28H+=l8CO2↑+23H2O
D.过程①和②中被降解的苯酚的物质的量之比为1:3
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】有下列化学仪器:①托盘天平;②玻璃棒;③药匙;④烧杯;⑤量筒;⑥容量瓶;⑦胶头滴管。
(1)现需要配制500 mL 1 mol/L硫酸溶液,需用质量分数为98%、密度为1.84 g/cm3的浓硫酸________mL。
(2)从上述仪器中,按实验使用的先后顺序,其编号排列是_______。
(3)容量瓶使用前检验漏水的方法是_______。
(4)若实验遇到下列情况,对硫酸溶液的物质的量浓度有何影响(填“偏高”、“偏低”或“不变”)
①未经冷却趁热将溶液注入容量瓶中,_______________;
②摇匀后发现液面低于刻度线再加水,_____________;
③容量瓶中原有少量蒸馏水,_______________;
④定容时观察液面俯视,_____________;
⑤未将洗涤液注入容量瓶中,_______________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】在水溶液中,重铬酸钾K2Cr2O7存在以下平衡:Cr2O72-+H2O![]() 2CrO42-+2H+,下列说法正确的是( )
2CrO42-+2H+,下列说法正确的是( )
A.向该溶液中加入过量浓NaOH溶液后,溶液呈橙红色
B.该反应是氧化还原反应
C.向该溶液中滴加适量的浓硫酸,平衡向逆反应方向移动,再次达到平衡后,氢离子浓度比原溶液大
D.该反应的平衡常数表达式是K=c2(CrO42-)c2(H+)/c(Cr2O72-)c(H2O)
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某2.0L硫酸溶液中含有1.0mol H2SO4.试计算:
(1)溶液中H2SO4的物质的量浓度;
(2)向上述溶液中加入足量的铁粉,产生气体的体积(标准状况);
(3)假设反应前后溶液体积不变,则所得溶液中Fe2+的物质的量浓度.
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】我国秦俑彩绘和汉代器物上用的颜料被称为“中国蓝”、“中国紫”,近年来,人们对这些颜料的成分进行了研究,发现其成分主要为BaCuSi4O10、BaCuSi2O6。
(1)“中国蓝”、“中国紫”中均有Cun+离子,n=___________,基态时该阳离子的价电子排布式为___________。
(2)“中国蓝”的发色中心是以Cun+为中心离子的配位化合物,其中提供孤对电子的是____元素。
(3)已知Cu、Zn的第二电离能分别为1957.9kJ·mol-1、1733.3kJ·mol-1,前者高于后者的原因是________________________________________。
(4)铜常用作有机反应的催化剂。例如,2CH3CH2OH+O2![]() 2CH3CHO+2H2O。乙醛分子中碳原子的杂化轨道类型是___________;乙醛分子中σ键与π键的个数比为___________。
2CH3CHO+2H2O。乙醛分子中碳原子的杂化轨道类型是___________;乙醛分子中σ键与π键的个数比为___________。
(5)铜的晶胞如图所示。铜银合金是优质的金属材料,其晶胞与铜晶胞类似,银位于顶点,铜位于面心。

①该铜银合金的化学式是___________________。
②已知:该铜银晶胞参数为acm,晶体密度为ρg·cm-3。
则阿伏加德罗常数(NA)为_______mol-1(用代数式表示,下同)。
③若Ag、Cu原子半径分别为bcm、ccm,则该晶胞中原子空间利用率φ为___________。(提示:晶胞中原子空间利用率=![]() ×100%)
×100%)
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】25℃时,用0.1molL-1NaOH溶液滴定某二元弱酸H2A,H2A被滴定分数、pH及物种分布分数δ[δ(X)=![]() ]如图所示:
]如图所示:
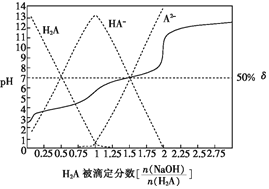
下列说法错误的是( )
A.用NaOH溶液滴定0.1molL-1NaHA溶液可用酚酞作指示剂
B.0.1molL-1NaHA溶液中:c(Na+)>c(HA-)>c(H2A)>c(A2-)
C.0.1molL-1Na2A溶液中:c(Na+)>c(HA-)+2c(A2-)
D.H2A的Ka2=1×10-7
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】汽车尾气已成为城市空气的主要污染源之一,其中的氮氧化物是重要污染物。
(1)汽车内燃机工作时产生NO的原理如图1所示:

该反应的热化学方程式为______。
(2)治理尾气的方法之一是在排气管上安装催化转化器,发生如下反应:2NO(g)+2CO(g)![]() N2(g)+2CO2(g) ΔH<0。若在一定温度下将2mol NO、1mol CO充入1L固定容积的容器中,反应过程中各物质的浓度变化如图2所示。
N2(g)+2CO2(g) ΔH<0。若在一定温度下将2mol NO、1mol CO充入1L固定容积的容器中,反应过程中各物质的浓度变化如图2所示。
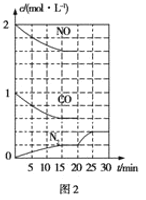
①则从开始到达到平衡状态的过程中,平均反应速率υ(CO2)=____,该温度下反应的平衡常数K=____(结果保留两位有效数字)
②20min时改变的条件可能是____
A.增大压强 C.减小CO2浓度且改用更高效的催化剂
B.降低温度 D.在恒温恒容条件下,充入He气体
③若保持温度不变,20min时向容器中充入CO、N2各0.6mol,平衡将____(填“正向”“逆向”或“不”)移动。
(3)用焦炭还原NO2的反应为:2NO2(g)+2C(s)![]() N2(g)+2CO2(g),在恒温条件下,向1L密闭容器中加入不同物质的量的NO2和足量C发生该反应,测得平衡时NO2和CO2的物质的量浓度与平衡总压强的关系如图3所示。
N2(g)+2CO2(g),在恒温条件下,向1L密闭容器中加入不同物质的量的NO2和足量C发生该反应,测得平衡时NO2和CO2的物质的量浓度与平衡总压强的关系如图3所示。
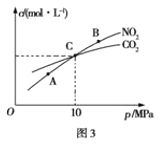
①下列不能说明该反应已达到平衡状态的是_____
a.C的质量不变 b. 混合气体的密度不再发生改变
c. v正(N2)=υ逆(CO2) d.混合气体的颜色不再改变
②计算C点时该反应的平衡常数Kp(C)=___(Kp是用平衡分压代替平衡浓度计算,分压=总压×物质的量分数)。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com