

 .1mol乙最多可与5mol H2反应.
.1mol乙最多可与5mol H2反应.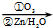 RCHO+R′CHO
RCHO+R′CHO .
. .
.分析 I.甲与HCl发生加成反应生成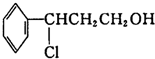 ,
,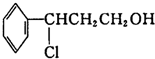 发生氧化反应生成Y为
发生氧化反应生成Y为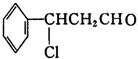 ,Y发生消去反应生成乙为
,Y发生消去反应生成乙为 ;
;
II.乙和臭氧氧化反应生成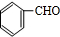 与OHC-CHO,乙和新制氢氧化铜悬浊液发生氧化反应然后酸化得到D,D的结构简式为
与OHC-CHO,乙和新制氢氧化铜悬浊液发生氧化反应然后酸化得到D,D的结构简式为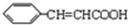 ,丙的分子式为C16H14O2,能与溴水、NaOH溶液反应,说明丙中有碳碳不饱和键和酯基,结合丙的分子式中碳原子数目可知,可知B为
,丙的分子式为C16H14O2,能与溴水、NaOH溶液反应,说明丙中有碳碳不饱和键和酯基,结合丙的分子式中碳原子数目可知,可知B为 ,
,
则A为OHC-CHO,B与氢气发生加成反应生成C为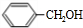 ,丙的结构简式为
,丙的结构简式为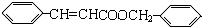 ,据此解答;
,据此解答;
解答 解:I.甲与HCl发生加成反应生成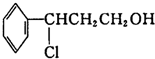 ,
,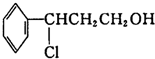 发生氧化反应生成Y为
发生氧化反应生成Y为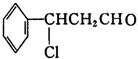 ,Y发生消去反应生成乙为
,Y发生消去反应生成乙为 ;
;
(1)乙的结构简式为 ,苯环、碳碳双键、醛基均与氢气发生加成反应,1mol乙最多可与 5mol H2反应,
,苯环、碳碳双键、醛基均与氢气发生加成反应,1mol乙最多可与 5mol H2反应,
故答案为: ;5;
;5;
(2)对比甲乙的结构简式,简述上述过程由甲合成乙的设计意图为将甲中的羟基氧化为醛基,同时又保护了碳碳双键不被氧化,
故答案为:将甲中的羟基氧化为醛基,同时又保护了碳碳双键不被氧化;
II.乙和臭氧氧化反应生成 与OHC-CHO,乙和新制氢氧化铜悬浊液发生氧化反应然后酸化得到D,D的结构简式为
与OHC-CHO,乙和新制氢氧化铜悬浊液发生氧化反应然后酸化得到D,D的结构简式为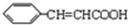 ,丙的分子式为C16H14O2,能与溴水、NaOH溶液反应,说明丙中有碳碳不饱和键和酯基,结合丙的分子式中碳原子数目可知,可知B为
,丙的分子式为C16H14O2,能与溴水、NaOH溶液反应,说明丙中有碳碳不饱和键和酯基,结合丙的分子式中碳原子数目可知,可知B为 ,则A为OHC-CHO,B与氢气发生加成反应生成C为
,则A为OHC-CHO,B与氢气发生加成反应生成C为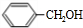 ,丙的结构简式为
,丙的结构简式为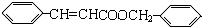 ,
,
(3)B→C是醛与氢气在催化剂、加热条件下发生的加成反应,D的结构简式为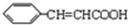 ,D中的官能团名称是碳碳双键和羧基,
,D中的官能团名称是碳碳双键和羧基,
故答案为:加成反应;碳碳双键和羧基;
(4)乙与新制Cu(OH)2反应的化学方程式为: ,
,
故答案为: ;
;
(5)同时符合下列要求的D(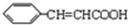 )的同分异构体的结构简式:a.属于二取代苯;b.分子中有5种不同环境的氢原子,其个数比为1:2:2:1:2;c.能使溴的CCl4溶液退色,且在酸性条件下可以发生水解反应,含有酯基、碳碳双键,该同分异构体结构简式为:
)的同分异构体的结构简式:a.属于二取代苯;b.分子中有5种不同环境的氢原子,其个数比为1:2:2:1:2;c.能使溴的CCl4溶液退色,且在酸性条件下可以发生水解反应,含有酯基、碳碳双键,该同分异构体结构简式为: ,
,
故答案为: .
.
点评 本题考查有机物推断及合成、有机反应类型、同分异构体书写等,注意根据有机物的结构与反应条件进行推断,关键是熟练掌握各种官能团结构和性质,有助于培养学生的逻辑推理能力和发散思维能力,题目难度中等.


 教学练新同步练习系列答案
教学练新同步练习系列答案 课前课后同步练习系列答案
课前课后同步练习系列答案 课堂小作业系列答案
课堂小作业系列答案 黄冈小状元口算速算练习册系列答案
黄冈小状元口算速算练习册系列答案 成功训练计划系列答案
成功训练计划系列答案 倍速训练法直通中考考点系列答案
倍速训练法直通中考考点系列答案科目:高中化学 来源: 题型:选择题
| A. | ①② | B. | ⑥⑧ | C. | ②⑤ | D. | ③④⑦ |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
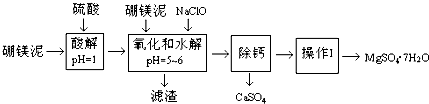
| 温度(℃) | 40 | 50 | 60 | 70 |
| MgSO4 | 30.9 | 33.4 | 35.6 | 36.9 |
| CaSO4 | 0.210 | 0.207 | 0.201 | 0.193 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 反应:SiO2+Na2CO3$\frac{\underline{\;高温\;}}{\;}$Na2SiO3+CO2↑,说明H2SiO3的酸性大于H2CO3的酸性 | |
| B. | 因为SO2具有漂白性,所以它能使品红溶液、溴水褪色 | |
| C. | 二氧化硅是生产光导纤维、玻璃的基本原料 | |
| D. | CO2、CH4、N2是温室气体 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| 类别 组合 | 酸性 氧化物 | 碱性 氧化物 | 电解质 | 强电解质 | 高分子 物质 |
| A | CO2 | CuO | 氨气 | NH3•H2O | 葡萄糖 |
| B | SO3 | Na2O | 稀硫酸 | NaOH | 果糖 |
| C | SO2 | CaO | 冰醋酸 | KOH | 纤维素 |
| D | N2O5 | Na2O2 | α-丙氨酸 | Cu(OH)2 | 聚乙烯 |
| A. | A | B. | B | C. | C | D. | D |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 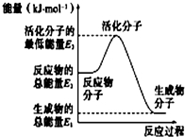 反应②中的能量变化如图所示,则△H2=E1-E3 | |
| B. | H2的燃烧热为241.8 kJ•mol-1 | |
| C. | 由反应②知在温度一定的条件下,在一恒容密闭容器中通入1 mol N2和3 mol H2,反应后放出的热量为Q1 kJ,若通入2 mol N2和6 mol H2反应后放出的热量为Q2 kJ,则184.8>Q2>2Q1 | |
| D. | 氨的催化氧化反应为4NH3(g)+5O2(g)=4NO(g)+6H2O(g)△H=+906 kJ•mol-1 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
 .
.
查看答案和解析>>
科目:高中化学 来源: 题型:推断题
 已知A、B、C、D四种元素均为短周期元素,原子序数依次递增,E为前30号元素.5种元素的部分特点:
已知A、B、C、D四种元素均为短周期元素,原子序数依次递增,E为前30号元素.5种元素的部分特点:| 元素 | 特 点 |
| A | 其气态氢化物呈三角锥形,水溶液显碱性 |
| B | 基态原子核外有三个能级,其中最外层电子数等于次外层电子数的3倍 |
| C | 基态原子占据两种形状的原子轨道,且最外层电子数等于最内层电子数 |
| D | 元素原子的外围电子层排布式为nsn-1npn-1 |
| E | 原子M能级层为全充满状态且核外的未成对电子只有一个 |
查看答案和解析>>
科目:高中化学 来源: 题型:推断题
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com