
【题目】向10.0 mL 0.10 mol/L氨水中滴入0.10 mol/L的盐酸,溶液的pH与所加盐酸的体积关系如图所示(假设无气体逸出)。下列有关叙述正确的是( )
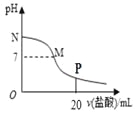
A. M~N间一定存在:c(Cl-)>c(NH4+)>c(OH-)>c(H+)
B. M点对应的盐酸体积为10.0mL
C. pH=7的溶液中:c(NH4+)=c(Cl-)=c(H+)=c(OH-)
D. P点处的溶液中存在:2c(NH4+)+2c(NH3·H2O)=c(Cl-)
科目:高中化学 来源: 题型:
【题目】肼(![]() )可作为火箭发动机的燃料,NH3与NaClO反应可得到肼。
)可作为火箭发动机的燃料,NH3与NaClO反应可得到肼。
(1)实验室用氯化铵和氢氧化钙制备氨气的化学方程式:__________________
(2)已知:①N2(g)+2O2(g)=N2O4(l) ΔH1=-195kJ·mol-1
②N2H4(l)+O2(g)=N2(g)+2H2O(g) ΔH2=-534kJ·mol-1
写出液态肼和N2O4(l)反应生成N2和水蒸气的热化学方程式:__________________
(3)已知断裂1 mol化学键所需的能量(kJ)如下:N≡N为942、O=O为498、N-N为154、H-O为464、请根据N2H4(l) +O2(g)= N2(g) +2H2O(g) ΔH2=-534kJ·mol-1中数据计算断裂1 molN-H键所需的能量(kJ)是:__________________
(4)写出NH3与NaClO反应得到肼的化学方程式:____________________
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】(I)将下列物质进行分类:①H与D②O2与O3③乙醇(C2H5OH)与甲醚(CH3-O-CH3)④正丁烷与异丁烷⑤C60与金刚石
(1)互为同位素的是_______(填编号、下同);
(2)互为同素异形体的是_______ ;
(3)互为同分异构体的是________;
(II)反应Fe + H2SO4=== FeSO4+ H2↑的能量变化趋势如图所示:
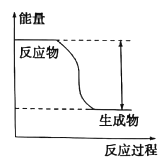
(1)该反应为 _______反应(填“吸热”或“放热”)。
(2)若要使该反应的反应速率加快,下列措施可行的是______(填字母)。
A.改铁片为铁粉 B. 改稀硫酸为98%的浓硫酸 C.适当升高温度
(3)若将上述反应设计成原电池,铜为原电池某一极材料,则铜为_____(填“正”或“负”)极。该极上发生的电极反应为___________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】向含MgCl2和CuCl2的溶液中逐滴加入0.1 mol·L-1的NaOH溶液,沉淀的质量(m)与加入NaOH溶液体积(V)的关系如图所示,已知V2 =3V1,下列说法正确的是( )
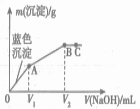
A. 原溶液中MgCl2和CuCl2的物质的量浓度相等
B. 该实验不能证明Cu(OH)2的Ksp比Mg(OH)2的Ksp小
C. 水的电离程度:A>B>C
D. 若向Mg(OH)2悬浊液中加入CuCl2溶液,一定会有Cu(OH)2生成
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】NOx会造成大气污染,在工业上采用多种方法进行处理。
I.氧化法:烟气中的NO经O3预处理后转化为NO2,再用CaSO3悬浊液吸收NO2。
已知:常温下,CaSO4的沉淀溶解平衡常数数值为9.1×10-6,CaSO3的沉淀溶解平衡常数数值为3.1×10-7。
(1)NO与O3反应过程的能量变化如下:
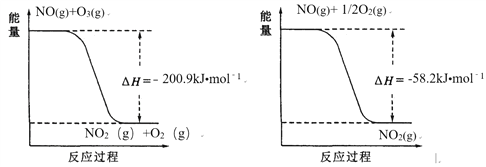
NO被O3氧化的总反应是化合反应,该反应的热化学方程式为 ________。
(2)将CaSO3悬浊液静置,取上层清液,测得pH约为8,用化学用语解释其原因为________。
(3)用CaSO3悬浊液吸收NO2,将其转化为HNO2,该反应的化学方程式为________。
(4)在实际吸收NO2的过程中,通过向CaSO3悬浊液中加入Na2SO4固体,提高NO2的吸收速率,从溶解平衡的角度解释其原因:________。
II. 选择性非催化还原法:该反应不使用催化剂,但必须在高温有氧下利用NH3做还原剂与 NOx 进行选择性反应:4NH3 + 4NO + O2 ![]() 3N2 + 6H2O,不同温度(T)下,反应时间(t)与NO浓度的关系如右图所示。
3N2 + 6H2O,不同温度(T)下,反应时间(t)与NO浓度的关系如右图所示。
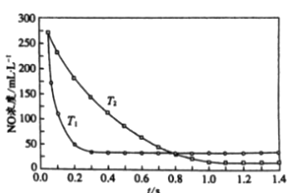
(5)判断该反应为________(填“吸热”或“放热”)反应,说明理由:________ 。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列关于有机物的叙述正确的是( )
A. 乙烯、聚乙烯均能使溴水褪色
B.  和
和 互为同分异构体
互为同分异构体
C. 苯在催化剂作用下能与浓硝酸发生取代反应
D. 等质量的甲烷和乙烯完全燃烧,乙烯消耗的O2多![]()
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】用0.001mol/L的酸性高锰酸钾溶液滴定未知浓度的草酸(H2C2O4)溶液,回答下列 问题:
(1)酸性高锰酸钾溶液应该装在下图__________滴定管中。

(2)请写出该反应的离子方程式:____________________。
(3)用0.001mol/L的酸性高锰酸钾溶液滴定草酸溶液,滴定终点的判断依据是:_________________。
(4)己知滴定V1ml待测液消耗标准液实验数据如下表
实验次数 | 始读数(ml) | 末读数(ml) | 消耗体积 |
1 | 0.10 | 19.20 | 19.10 |
2 | 1.85 | 20.75 | 18.90 |
3 | 0.00 | 24.06 | 24.06 |
则待测液的浓度为:_______________
(5)滴定结束时,俯视刻度线读取高锰酸钾溶液的体积,会导致测定结果_________(填“偏大”“偏小”或“不影响”)
(6)己知NaHC2O4溶液中草酸氢根离子的电离大于水解,则溶液中各离子的浓度按由大到小的顺序排列的是:_________________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】为了减少钢管因锈蚀造成的损失,某城市拟用如图方法保护埋在酸性土壤中的钢管。下列有关说法错误的是
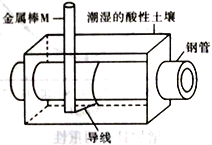
A. 在潮湿的酸性土壤中钢管主要发生析氢腐蚀
B. 在潮湿的酸性土壤中金属棒M 将电子通过导线流向钢管
C. 在潮湿的酸性土壤中H+向金属棒M 移动,抑制H+与铁的反应
D. 金属棒M 与钢管用导线连接后可使钢管表面的腐蚀电流接近于零
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com