
| A. | 在标准状况下,1L的密闭容器中恰好可盛放n个N2分子和m个H2分子组成的混合气体,则阿伏伽德罗常数NA可近似表示为$\frac{m+n}{22.4}$mol-1 | |
| B. | 标准状况下,32g O3和O2的混合气体中,含有氧原子数一定为2NA | |
| C. | 等体积、等浓度的磷酸溶液和盐酸溶液,其溶液中含有的氢元素质量之比一定为3:1 | |
| D. | 等物质的量的干冰和葡萄糖(C6H12O6)中所含碳原子数之比一定为2:6 |
分析 A.根据n=$\frac{V}{{V}_{m}}$计算混合气体总物质的量,再根据N=nNA计算;
B.氧原子质量为32g,根据n=$\frac{m}{M}$计算氧原子物质的量,再根据N=nNA计算氧原子数目;
C.溶液中H元素质量包含水中含有H元素、溶质中H元素质量,不能确定氢元素质量之比;
D.结合分子中碳原子数目判断.
解答 解:A.混合气体总物质的量为$\frac{1L}{22.4L/mol}$=$\frac{1}{22.4}$mol,则(n+m)=$\frac{1}{22.4}$mol×NA,则NA=22.4(n+m) mol-1,故A错误;
B.氧原子质量为32g,氧原子物质的量为$\frac{32g}{32g/mol}$=1mol,再含有2molO原子,含有氧原子数一定为2NA,故B正确;
C.溶液中H元素质量包含水中含有H元素、溶质中H元素质量,不能确定氢元素质量之比,故C错误;
D.等物质的量的干冰和葡萄糖(C6H12O6)中所含碳原子数之比一定为1:6,故D错误,
故选:B.
点评 本题考查物质的量有关计算,注意对公式的理解与灵活应用,C选项为易错点,学生容易忽略溶剂水中氢元素.


 A加金题 系列答案
A加金题 系列答案 全优测试卷系列答案
全优测试卷系列答案科目:高中化学 来源: 题型:选择题
| A. | Na与H2O 的反应是熵增的放热反应,该反应能自发进行 | |
| B. | 相同条件下,等质量的碳按a、b两种途径完全转化,途径途径a比途径b放出更多热能途径途径a:C $→_{高温}^{H_{2}O}$CO+H2 $→_{燃烧}^{O_{2}}$CO2+H2O 途径b:C$→_{燃烧}^{O_{2}}$ CO2 | |
| C. | FeCl3和MnO2均可 加快H2O2分解,同等条件下二者对H2O2分解速率的改变相同 | |
| D. | Mg在CO2中燃烧生成MgO和C的反应中,化学能全部转化为热能 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
 4种相邻主族短周期元素的相对位置如表,元素X的核外电子数是元素M的2倍,Y的氧化物具有两性,回答下列问题.
4种相邻主族短周期元素的相对位置如表,元素X的核外电子数是元素M的2倍,Y的氧化物具有两性,回答下列问题. ,气体分子(MN)2的电子式:
,气体分子(MN)2的电子式: ,X形成的离子的电子式:Mg2+.
,X形成的离子的电子式:Mg2+.查看答案和解析>>
科目:高中化学 来源: 题型:解答题
 |  |  |  | |
| 添加试剂 | 10.0mlFeSO4溶液 | 10.0mlFeSO4溶液+2ml煤油 | 10.0mlFeSO4溶液+1.0铁粉 | 10.0mlFeSO4溶液+ 少量(或几滴)硫酸 |
| 3天内的现象 | 溶液颜色很快变成黄色,并出现棕黄色浑浊 | / | / | / |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
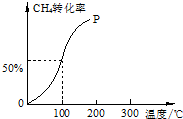 以CH4和H2O为原料,通过下列反应来制备甲醇.
以CH4和H2O为原料,通过下列反应来制备甲醇.查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | ②⑤⑥ | B. | ①③⑥ | C. | ②⑥⑦ | D. | ②⑤⑥ |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 常温常压下,16 gO2中含有的氧分子数为NA | |
| B. | 1 molOH-中含有的电子数为10NA | |
| C. | 标准状况下,11.2 L H2O中含有的氢原子数为NA | |
| D. | 1 mol/LBaCl2溶液中含有的钡离子数为NA |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | NiOOH | B. | Ni(OH)2 | C. | Cd | D. | Cd(OH)2 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com