
【题目】缓解当前能源和资源紧张问题的方法无非是开源和节流两个方面,从开源角度看,有效地开发利用燃煤产生的CO2重新合成新的燃料是一个途径,目前工业上用CO2来生产甲醇的原理是CO2(g)+3H2(g)![]() CH3OH(g)+H2O(g),
CH3OH(g)+H2O(g),
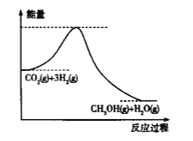
(1)上述反应过程中的能量变化如图所示,该反应是_____________(填“吸热”或“放热”)反应。
(2)一定温度下,将5molCO2和8molH2充入2L恒容密闭容器中发生上述反应,测得H2的物质的量与时间的关系如图所示,
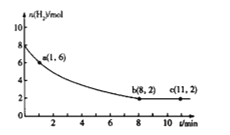
0-1min内,用CO2表示的平均反应速率v(CO2)=________________(保留两位有效数字);a点的逆反应速率________________b点的逆反应速率(填“>”“<”或“=”)。
(3)对于在恒温恒容条件下进行的反应CO2(g)+3H2(g)![]() CH3OH(g)+H2O(g),下列叙述不能说明其已达到平衡状态的是________________(填序号)。
CH3OH(g)+H2O(g),下列叙述不能说明其已达到平衡状态的是________________(填序号)。
a. 混合气体的密度不再改变
b. 容器内的压强不再发生变化
c. CH3OH(g)的浓度保持不变
d. 单位时间内消耗1molCO2,同时生成1molCH3OH
(4)甲醇燃料电池是一种高效、环境友好的发电装置,结构如图所示(电解质溶液为稀硫酸):

①Pt(b)电极上发生_____________(填“氧化”或“还原”)反应,电极反应式为________________________。
②如果该电池工作时导线中通过3mol电子,则理论上消耗甲醇的物质的量为__________________。
【答案】放热 0.33mol/(L·min) < ad 还原 O2+4e-+4H+=2H2O 0.5mol
【解析】
(1)根据吸热反应、放热反应中反应物和生成物的能量大小关系分析;
(2)根据速率的计算公式进行计算;根据可逆反应平衡建立过程中正逆反应速率的变化分析;
(3)由化学平衡状态的判断方法分析;
(4)由燃料电池的工作原理分析解答。
(1)由能量变化图可知,该反应中反应物的总能量高于生成物的总能量,故该反应为放热反应;
(2)由图像可知,0-1min内,![]() ,则
,则![]() ,则用CO2表示的平均反应速率
,则用CO2表示的平均反应速率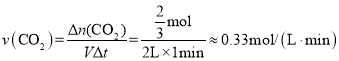 ;由于该反应是从正反应方向建立平衡的,则在平衡之前,正反应反速率逐渐减小,逆反应速率逐渐增大,故a点的逆反应速率<b点的逆反应速率;
;由于该反应是从正反应方向建立平衡的,则在平衡之前,正反应反速率逐渐减小,逆反应速率逐渐增大,故a点的逆反应速率<b点的逆反应速率;
(3)反应条件为恒温、恒容,该反应CO2(g)+3H2(g)![]() CH3OH(g)+H2O(g)的正反应方向是气体分子数减少的反应,
CH3OH(g)+H2O(g)的正反应方向是气体分子数减少的反应,
a. 由质量守恒定律可知,混合气体的质量始终保持不变,又容器的容积不变,则混合气体的密度始终保持改变,则混合气体的密度不再改变时,不能说明反应已达到平衡状态,故a符合;
b. 该反应的正反应方向是气体分子数减少的反应,则随着反应的进行,容器内压强会发生变化,故容器内的压强不再发生变化时,能说明反应已达到平衡状态,故b不符合;
c. CH3OH(g)的浓度保持不变,说明正逆反应速率相等,能说明反应已达到平衡状态,故c不符合;
d. 单位时间内消耗1molCO2,同时生成1molCH3OH,均表示正反应速率,不能说明正逆反应速率相等,故单位时间内消耗1molCO2,同时生成1molCH3OH时,不能说明反应已达到平衡状态,故d符合;
故选ad;
(4)甲醇燃料电池通入燃料甲醇的一极为负极,即Pt(a)电极为负极,通入氧气的一极为正极,即Pt(b)电极为正极,电解质溶液为稀硫酸,
①Pt(b)电极为正极,发生还原反应,电极反应式为O2+4e-+4H+=2H2O;
②Pt(a)电极为负极,发生氧化反应,电极反应式为![]() ,由关系式
,由关系式![]() 可知,如果该电池工作时导线中通过3mol电子,则理论上消耗甲醇的物质的量为0.5mol。
可知,如果该电池工作时导线中通过3mol电子,则理论上消耗甲醇的物质的量为0.5mol。


 阅读快车系列答案
阅读快车系列答案科目:高中化学 来源: 题型:
【题目】(1)苯氯乙酮是一具有荷花香味且有强催泪作用的化学试剂,它的结构简式如图所示![]() ,则苯氯乙酮不可能具有的化学性质是___(填字母序号)。
,则苯氯乙酮不可能具有的化学性质是___(填字母序号)。
a.加成反应 b.取代反应 C.消去反应d.水解反应 e.银镜反应 f.还原反应
(2)由丙烯经下列反应可制得F、G两种高分子化合物,它们都是常用的塑料。
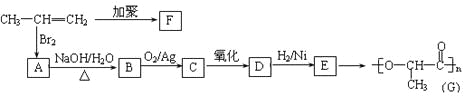
①聚合物F的结构简式:_________________________________________。
②c与新制的Cu(OH)2碱性悬浊液共热转化为D的化学方程式是:________________。
③在一定条件下,两分子E能脱去两分子水形成一种六元环状化合物,该化合物的结构简式是:________________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】物质检验、分离、提纯和制备是化学实验中的常见操作。
(1)除去FeCl3溶液中混有的FeCl2可采取的方法是______(用离子方程式表示)。
(2)检验食盐中所含阳离子的实验操作名称是_________。
(3)检验Fe2(SO4)3溶液中是否含有FeSO4所用试剂是_________。
(4)实验室制备氯气的化学反应方程式为_______,请在方程式中标出电子转移的方向和数目。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】t℃时,在体积不变的密闭容器中发生反应:X(g)+3Y(g)![]() 2Z(g),各组分在不同时刻的浓度如下表:下列说法正确的是( )
2Z(g),各组分在不同时刻的浓度如下表:下列说法正确的是( )
物质 | X | Y | Z |
初始浓度(mol/L) | 0.1 | 0.2 | 0 |
2min末浓度(mol/L) | 0.08 | a | b |
平衡浓度(mol/L) | 0.05 | 0.05 | 0.1 |
A.平衡时,X的转化率为20%
B.t℃时,2min末Y与Z的物质的量浓度:a=0.06mol/L,b=0.4mol/L
C.增大平衡后的体系压强,v正增大,v逆减小,平衡向正反应方向移动
D.前2min内,用Y的变化量表示的平均反应速率v(Y)=0.03mol/(L·min)
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】设NA为阿伏伽德罗常数的值。下列说法正确的是
A. 标准状况下,0.1mol Cl2溶于水,转移的电子数目为0.1NA
B. 标准状况下,2.24L NO和2.24L O2混合后气体分子数为0.15 NA
C. 加热条件下,1mol Fe投入足量的浓硫酸中,生成NA个SO2分子
D. 0.1mol Na2O2与足量的潮湿的二氧化碳反应转移的电子数为0.1NA
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】硝苯地平是抗心绞痛药,也可用于降血压,其合成路线如下。
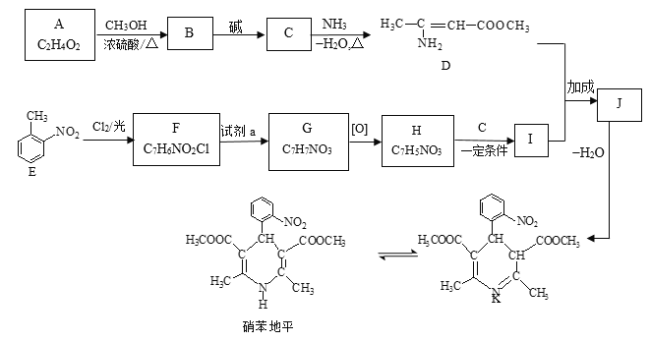
已知: Ⅰ. RCOOR1+![]()
![]()
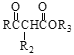 +R1OH
+R1OH
Ⅱ. R1CHO+![]()
![]()
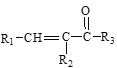
Ⅲ.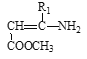 +
+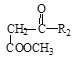
![]()
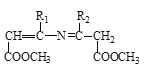
![]()
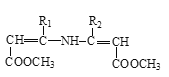
请回答下列问题:
(1)A属于羧酸,写出A的电离方程式________。
(2)A→B的反应类型为________。
(3)D的官能团名称为________。
(4)写出B→C的方程式________。
(5)F→G所需的试剂a是________。
(6)聚合物L的单体是E的同分异构体,其单体结构同时满足以下条件,写出L的结构简式:________。
a. 具有两性 b. 苯环上的一氯代物共有两种
(7)写出结构简式:I________ 、J________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列离子方程式正确的是( )
A.NH3·H2O在水中的电离:NH3·H2O=NH4++OH
B.苯酚钠溶液中通入少量CO2:2![]() +CO2+H2O=2
+CO2+H2O=2![]() +CO32-
+CO32-
C.FeCl3溶液腐蚀铜板:Fe3++Cu=Fe2++Cu2+
D.碳酸氢钙溶液中加少量澄清石灰水:Ca2++HCO3-+OH-=CaCO3↓+H2O
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】A、B、C、D都是中学化学中常见物质,其中A、B、C均含有同一种元素,在一定条件下相互转化关系如下(部分反应中的水已略去)。根据题意回答下列问题:
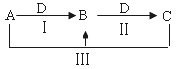
(1)若A、B、C的焰色反应均为黄色,C为厨房中的用品,D的过度排放会造成温室效应。
①A的化学式______________、B的俗名____________;
②反应II的离子方程式是__________________________________。
(2)若A、D均为单质,且A为气体,D元素的一种红棕色氧化物常用作颜料。
①反应II的离子方程式是_____________________________;
②反应Ⅲ的离子方程式是_____________________________;
③检验B中阳离子最好的方法是_____________________________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列实验现象与实验操作不相匹配的是
实验操作 | 实验现象 | |
A | 向盛有高锰酸钾酸性溶液的试管中通入足量的乙烯后静置 | 溶液的紫色逐渐褪去,静置后溶液分层 |
B | 将镁条点燃后迅速伸入集满CO2的集气瓶 | 集气瓶中产生浓烟并有黑色颗粒产生 |
C | 向盛有饱和硫代硫酸钠溶液的试管中滴加稀盐酸 | 有刺激性气味气体产生,溶液变浑浊 |
D | 向盛有FeCl3溶液的试管中加过量铁粉,充分振荡后加1滴KSCN溶液 | 黄色逐渐消失,加KSCN后溶液颜色不变 |
A. AB. BC. CD. D
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com