
��O2��HClת��ΪCl2�������Ч�棬������Ⱦ��
��1����ͳ�ϸ�ת��ͨ������ͼ��ʾ�Ĵ���ѭ��ʵ�֣�
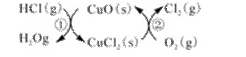
���У���Ӧ��Ϊ��2HCl(g) + CuO(s) 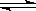 H2O(g)+CuCl2(g) ��H1
H2O(g)+CuCl2(g) ��H1
��Ӧ������1molCl2(g)�ķ�Ӧ��Ϊ��H2�����ܷ�Ӧ���Ȼ�ѧ����ʽΪ , (��Ӧ���á�H1�͡�H2��ʾ)��
��2������RuO2����������HClת��ΪCl2���ܷ�Ӧ���и��õĴ� �����ԣ�
�����ԣ�
��ʵ������һ��ѹǿ�£��ܷ�Ӧ��HClƽ��ת�������¶ȱ仯��aHCl��T������ͼ12�����ܷ�Ӧ�ġ�H 0 ,�����������������������A��B�����ƽ�ⳣ��K(A)��K(B)�нϴ���� ��
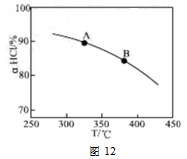
��������ʵ������ѹ�����ʹѹǿ��������ӦaHCl��T���ߵ�ʾ��ͼ������Ҫ˵�����ɣ� ��
�����д�ʩ�����������aHCl���� ��
A������n(HCl) B������n(O2) C��ʹ�ø��õĴ��� D����ȥH2O
��3��һ�������²�÷�Ӧ������n(Cl2)���������£�
| t(min) | 0 | 2.0 | 4.0 | 6.0 | 8.0 |
| n(Cl2)/10-3mol | 0 | 1.8 | 3.7 | 5.4 | 7.2 |
����2.0��6.0min����HCl�����ʵ����仯��ʾ�ķ�Ӧ���ʣ���mol��min-1Ϊ��λ��д��������̣���
��4��Cl2��;�㷺��д����Cl2�Ʊ�Ư�۵Ļ�ѧ����ʽ��
���𰸡�(1) 2HCl(g) + 1/2O2(g) H2O(g)+Cl2(g) ��H=��H1+��H2
H2O(g)+Cl2(g) ��H=��H1+��H2
(2) �٣� ��K(A)���ڼ���ͼ 
����ѹǿ��ƽ�����ƣ���HCl������ͬ�¶��£�HCl��ƽ��ת���ʱ�֮ǰʵ��Ĵ� ��B��D
(3)�⣺��2.0��6.0minʱ���ڣ�HClת�������ʵ���Ϊn����
2HCl(g) + 1/2O2(g) == H2O(g)+Cl2(g)
2 1
n (5.4-1.8)��10-3mol
��� n=7.2��10-3mol������v(HCl)= 7.2��10-3mol/(6.0-2.0)min==1.8��10-3mol/min
(4)2Cl2+2Ca(OH)2==CaCl2+Ca(ClO)2+2H2O
������������ͼ����Ϣ����ͷָ������������д����Ӧ�ڵ��Ȼ�ѧ����ʽ��CuCl2(g)+1/2O2(g) CuO(s) +Cl2(g) ��H2�����+�ڿɵ��ܷ�Ӧ����2���ٸ���ͼ12��֪�����¶ȵ����ߣ�aHCl��С��˵��������
CuO(s) +Cl2(g) ��H2�����+�ڿɵ��ܷ�Ӧ����2���ٸ���ͼ12��֪�����¶ȵ����ߣ�aHCl��С��˵�������� �ȣ�ƽ���������ƶ������֪�淴Ӧ���ȷ�Ӧ����������Ӧ�Ƿ��ȷ�Ӧ���ʡ�H��0��ͬʱ���������¶ȣ�ƽ�����ƣ�����������٣��¶���B�����A�㣬����ƽ�ⳣ��K(A) ��K(B)����ͬʱ���ڸ��ܷ�Ӧ������ϵ����С�ķ�Ӧ�����ԣ�ѹ�����ʹѹǿ����һ���¶��£�ƽ��Ӧ�����ƶ�����HClӦ����Ŀʵ��״̬��Ϊ�����Կɵ�����ͼ:
�ȣ�ƽ���������ƶ������֪�淴Ӧ���ȷ�Ӧ����������Ӧ�Ƿ��ȷ�Ӧ���ʡ�H��0��ͬʱ���������¶ȣ�ƽ�����ƣ�����������٣��¶���B�����A�㣬����ƽ�ⳣ��K(A) ��K(B)����ͬʱ���ڸ��ܷ�Ӧ������ϵ����С�ķ�Ӧ�����ԣ�ѹ�����ʹѹǿ����һ���¶��£�ƽ��Ӧ�����ƶ�����HClӦ����Ŀʵ��״̬��Ϊ�����Կɵ�����ͼ:  ��
��
��A������n(HCl) ��ƽ�������ƶ�������ƽ���ƶ�ʹHCl���ٵ�����С������HClʹ��������ƣ�����HCl��ת���ʼ�С������B������n(O2) ����Ӧ���Ũ������ƽ�������� �ƶ���HClת�������ԣ�C��ʹ�ø��õĴ���������ʹ��ѧƽ�ⷢ���ƶ���ʵ��HCl��ת���ʲ��䣬���� D����ȥH2O������С���������Ũ�ȣ�ƽ��������Ӧ�����ƶ���HClת�������ԡ��ʴ���ѡ��B��D����3����Ŀ�и�������n(Cl2)�����ݣ�Ҫ�������HCl�����ʵ����仯��ʾ�ķ�Ӧ���ʣ����Ը��ݷ���ʽ���м�
�ƶ���HClת�������ԣ�C��ʹ�ø��õĴ���������ʹ��ѧƽ�ⷢ���ƶ���ʵ��HCl��ת���ʲ��䣬���� D����ȥH2O������С���������Ũ�ȣ�ƽ��������Ӧ�����ƶ���HClת�������ԡ��ʴ���ѡ��B��D����3����Ŀ�и�������n(Cl2)�����ݣ�Ҫ�������HCl�����ʵ����仯��ʾ�ķ�Ӧ���ʣ����Ը��ݷ���ʽ���м� �㣬ע����2.0��6.0min�ڵ����ʣ���λ��mol��min-1����2.0��6.0min�ڣ�HClת�������ʵ���Ϊn����
�㣬ע����2.0��6.0min�ڵ����ʣ���λ��mol��min-1����2.0��6.0min�ڣ�HClת�������ʵ���Ϊn����
2HCl(g) + 1/2O2(g)��H 2O(g)+Cl2(g)
2O(g)+Cl2(g)
2 1
n (5.4-1.8)��10-3mol
��� n=7.2��10-3mol������v(HCl)= 7.2��10-3mol/(6.0-2.0)min==1.8��10-3mol/min
��4��Cl2��ʯ���鷢����Ӧ��ȡƯ�ۣ���Ӧ�Ļ�ѧ����ʽΪ��2Cl2+2Ca(OH)2��CaCl2+Ca(ClO)2+2H2O��



 Сѧ��10���ӿ������100��ϵ�д�
Сѧ��10���ӿ������100��ϵ�д�
| �꼶 | ���пγ� | �꼶 | ���пγ� |
| ��һ | ��һ��ѿγ��Ƽ��� | ��һ | ��һ��ѿγ��Ƽ��� |
| �߶� | �߶���ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
| ���� | ������ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
�ڲ�ͬŨ�ȣ�c)���¶ȣ�T)�����£�����ˮ���˲ʱ���ʣ�v�����±��������жϲ���ȷ���ǣ� ��
|
| 0.600 | 0.500 | 0.400 | 0.300 |
| 318.2 | 3.60 | 3.00 | 2.40 | 1.80 |
| 328.2 | 9.00 | 7.50 | a | 4.50 |
| b | 2.16 | 1.80 | 1.44 | 1.08 |
A��a=6.00 B��ͬʱ�ı䷴Ӧ�¶Ⱥ����ǵ�Ũ�ȣ�v���ܲ���
C��b��318.2 D����ͬ�¶�ʱ������Ũ�ȼ���һ�������ʱ����ͬ
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
��֪�Ȼ�ѧ����ʽ��2H2(g)��O2(g)===2H2O(l)����H1����571.6 kJ��mol��1��������Ȼ�ѧ����ʽ��2H2O(l)===2H2(g)��O2(g)����H2������˵������ȷ����(����)
A���Ȼ�ѧ����ʽ�л�ѧ��������ʾ������
B���÷�Ӧ��H2������
C���÷�Ӧ�Ħ�H2����571.6 kJ��mol��1
D���÷�Ӧ�ɱ�ʾ36 gˮ�ֽ�ʱ����ЧӦ
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
��֪450��ʱ��2SO2(g)��O2(g) 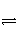
 2SO3(g)����H����Q1������ͬ�����£���һ�ܱ���
2SO3(g)����H����Q1������ͬ�����£���һ�ܱ���
����ͨ��1 mol SO2��0.5 mol O2���ﵽƽ��ʱ�ų�������ΪQ2����Q1��Q2����Ĺ�ϵ��
(����)
A��Q2��Q1/2 B��Q2<Q1/2 C��Q2>Q1/2 D������ȷ��
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
��֪�����ȼ���ȡ�H=-2215KJ��mol-1����һ�����ı�����ȫȼ�պ�����1.8gˮ����ų�������ԼΪ�� ��
A��55 kJ B��220 kJ C�� 550 kJ D��1108 kJ
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
���и���Ӧ�У����ڼӳɷ�Ӧ����(����)
A��CH2===CH2��Br2�D��CH2Br��CH2Br
B��CH3CH2OH��3O2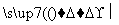 2CO2��3H2O
2CO2��3H2O
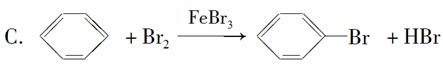
D��CH4��Cl2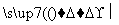 CH3Cl��HCl
CH3Cl��HCl
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
���и����л���ֻ��һ���Լ����������(����)
A���Ҵ����ױ������������� B���������ӡ���ϩ
C�������ױ��������� D�����ᡢ��ȩ������
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
�����л����������ȷ����(����)
A���������飺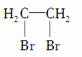
B��3�һ�1��ϩ��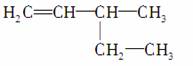
C��2��2,4����ϩ��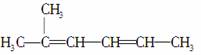
D��2,2,3�������飺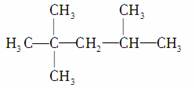
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
�������ӷ���ʽ��ȷ����(����)��
A�����ۼ������Ȼ�����Һ�� Fe +Fe3+ = 2Fe2+
B��Cl2��ˮ�ķ�ӦCl2 + H2O === 2H+ + Cl ��+ ClO����
C��ͭƬ������������Һ��Cu + Ag+ === Cu2+ + Ag
D������ʯ���ڴ���ķ�ӦCaCO3 + 2CH3COOH === Ca2+ + 2CH3COO- +CO2��+ H2O
�鿴�𰸺ͽ���>>
����ʡ������Υ���Ͳ�����Ϣ�ٱ�ƽ̨ | �����к���Ϣ�ٱ�ר�� | ����թƭ�ٱ�ר�� | ����ʷ���������к���Ϣ�ٱ�ר�� | ������Ȩ�ٱ�ר��
Υ���Ͳ�����Ϣ�ٱ��绰��027-86699610 �ٱ����䣺58377363@163.com