
 工业含铬废水的处理原理是将Cr2O72-转化为Cr3+,再将Cr3+转化为Cr(OH)3沉淀.利用硫酸工业废气中的SO2处理含铬废水,既充分利用资源、以废治废,还能节约生产成本.
工业含铬废水的处理原理是将Cr2O72-转化为Cr3+,再将Cr3+转化为Cr(OH)3沉淀.利用硫酸工业废气中的SO2处理含铬废水,既充分利用资源、以废治废,还能节约生产成本.分析 (1)由Cr2O72-~2Cr3+~6e-,SO2~SO42-~2e-,可得Cr2O72-~3SO2,根据关系式计算;
(2)根据Ksp[Cr(OH)3]=c(Cr3+)×c3(OH-)=1×10-30计算c(OH-),再结合水的离子积计算c(H+),根据pH=-lgc(H+)计算;
(3)温度升高过氧化氢分解平衡逆向进行;
(4)n(KMnO4)=0.4000mol/L×20ml×10-3L/ml=8.000×10-3mol,
n(Fe2+)=5×8.000×10-3mol=0.04000mol,依据发盐的化学式可知在久置的发盐中n(Al3+)=2×[0.04000mol+n(Fe3+)],
加入氨水后生成的干燥固体粉末中:
n(Al2O3)=0.04000mol+n(Fe3+)
n(Fe2O3)=$\frac{1}{2}$[0.04000mol+n(Fe3+)]
102g/mol×[0.04000mol+n(Fe3+)]+160g/mol×$\frac{1}{2}$×[0.04000mol+n(Fe3+)]=9.10g
n(Fe3+)=001000mol
n(Al3+)=2×[0.04000mol+n(Fe3+)]=0.1000mol
n(SO42-)=2n(Al3+)=0.2000mol
久置的发盐中的阳离子所带电荷总数:3n(Al3+)+2n(Fe2+)+3n(Fe3+)=0.4100mol
而已知的阴离子所带电荷总数2n(SO42-)=0.4000mol<0.4100mol,由于发盐在空气中被氧化,故其中还可能存在0.01000molOH-或0.00500molCO32-,据此书写化学式.
解答 解:(1)100LCr2O72-含量为108mg•L-1的含铬废水中含Cr2O72-物质的质量=100L×108mg•L-1的=10800mg=10.8g,物质的量n(Cr2O72-)=$\frac{10.8g}{216g/mol}$=0.05mol,
根据电子转移守恒:Cr2O72-~3SO2~6e-;
1 3
0.05mol n
所以n=0.15mol,
标准状况下体积=22.4L/mol×0.15mol=3.36L,
故答案为:3.36;
(2)室温下,除去被SO2还原所得溶液中的Cr3+(使其浓度小于1×10-6mol•L-1),Ksp[Cr(OH)3]=c(Cr3+)×c3(OH-)=1×10-30,则c(OH-)=10-8mol/L,c(H+)=$\frac{1{0}^{-14}}{1{0}^{-8}}$=10-6mol/L,则pH=6,需调节溶液pH>6,
故答案为:>6;
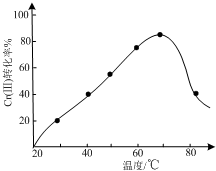
(3)三价铬Cr(Ⅲ)与双氧水反应可用于合成铬黄(PbCrO4),发生的是氧化还原反应,图象分析可知反应达到平衡状态达到最大转化率,温度升高超过70℃时过氧化氢分解,使平衡逆向进行,Cr(Ⅲ)转化率下降,
故答案为:较高温度下双氧水分解;
(4)n(KMnO4)=0.4000mol/L×20ml×10-3L/ml=8.000×10-3mol,
n(Fe2+)=5×8.000×10-3mol=0.04000mol,依据发盐的化学式可知在久置的发盐中n(Al3+)=2×[0.04000mol+n(Fe3+)],
加入氨水后生成的干燥固体粉末中:
n(Al2O3)=0.04000mol+n(Fe3+)
n(Fe2O3)=$\frac{1}{2}$[0.04000mol+n(Fe3+)]
102g/mol×[0.04000mol+n(Fe3+)]+160g/mol×$\frac{1}{2}$×[0.04000mol+n(Fe3+)]=9.10g
n(Fe3+)=001000mol
n(Al3+)=2×[0.04000mol+n(Fe3+)]=0.1000mol
n(SO42-)=2n(Al3+)=0.2000mol
久置的发盐中的阳离子所带电荷总数:3n(Al3+)+2n(Fe2+)+3n(Fe3+)=0.4100mol
而已知的阴离子所带电荷总数2n(SO42-)=0.4000mol<0.4100mol,由于发盐在空气中被氧化,故其中还可能存在0.01000molOH-或0.00500molCO32-,
该发盐的可能组成为n(Al3+):[n(Fe2+)+n(Fe3+)]:n(OH-):n(SO42-)=0.1:0.05:0.01:0.2=10:5:1:20,化学式为:Al10Fe5(OH)(SO4)20,
n(Al3+):[n(Fe2+)+n(Fe3+)]:n(CO32-):n(SO42-)=0.1:0.05:0.005:0.2=20:10:1:40,化学式为Al20Fe10(CO3)(SO4)40,
答:该久置发盐的可能化学组成为Al10Fe5(OH)(SO4)20或Al20Fe10(CO3)(SO4)40.
点评 本题考查物质组成的实验探究、溶度积常数计算、化学式计算应用、氧化还原反应定量计算的分析判断,掌握基础是解题关键,题目难度较大.


科目:高中化学 来源: 题型:选择题
| A. | 原电池中电子流出的一极是正极 | |
| B. | 原电池是将化学能转变为电能的装置 | |
| C. | 构成原电池的正极和负极必须是两种不同的金属 | |
| D. | 原电池放电时,电流的方向是从负极到正极 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 无色酚酞试液呈红色的溶液中:Na+、K+、SO42-、CO32- | |
| B. | 无色透明的溶液中:Cu2+、K+、SO42-、NO3- | |
| C. | 含有大量Ba(NO3)2的溶液中:Mg2+、NH4+、SO42-、Cl- | |
| D. | 紫色石蕊试液呈红色的溶液中:Ca2+、Cl-、Na+、HCO3- |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
| 实验编号 | T(K) | NO初始浓度 (mol•L-1) | CO初始浓度 (mol•L-1) | 催化剂的比表面积(m2/g) |
| Ⅰ | 400 | 1.00×10-3 | 3.60×10-3 | 82 |
| Ⅱ | 400 | 1.00×10-3 | 3.60×10-3 | 124 |
| Ⅲ | 450 | 1.00×10-3 | 3.60×10-3 | 124 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
族 周期 | ⅠA | ⅡA | ⅢA | ⅣA | ⅤA | ⅥA | ⅦA | 0 |
| 2 | ① | ② | ③ | |||||
| 3 | ⑨ | ④ | ⑤ | ⑩ | ⑥ | ⑦ | ⑧ |
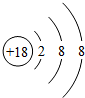 ;
; ,④元素与⑦元素形成化合物的电子式
,④元素与⑦元素形成化合物的电子式 .
.查看答案和解析>>
科目:高中化学 来源: 题型:多选题
| A. | 侯氏制碱、肥皂的制取工艺过程中均应用了物质溶解度的差异 | |
| B. | 使用可再生资源、用超临界二氧化碳替代有机溶剂、注重原子的经济性、采用低能耗生产工艺等都是绿色化学的内容 | |
| C. | 石油分馏、煤的气化、海水晒盐、碱去油污、花生中提取花生油等过程都是物理变化 | |
| D. | 合金超导材料是指熔合两种或两种以上的金属元素并形成具有超导电性的超导材料,如铌一钛(Nb-Ti)合金,通常它的熔点一般比纯钛要高. |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 20℃铁片 1mol/L硫酸 | B. | 30℃铁粉 1mol/L硫酸 | ||
| C. | 30℃铁粉 2mol/L硫酸 | D. | 30℃铁片 18mol/L硫酸 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com