
钴及其化合物可作为一些化学合成的催化剂,亦用于油漆、颜料、玻璃、釉瓷及电极板等的制造。
(1)粉红色、不溶于水的Co(OH)2具有两性,其溶于盐酸的离子方程式为_ ,Co(OH)2在空气中慢慢被氧化为棕褐色的Co(OH)3,反应的化学方程式为______________________。
(2)CoxNi(1-x)Fe2O4(其中Co、Ni均为+2价)可用作H2O2分解的催化剂,具有较高的活性。
①该催化剂中铁元素的化合价为_ 。
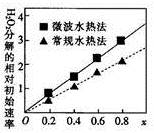
②两种不同方法制得的催化剂CoxNi(1-x)Fe2O4在10℃时催化分解6%的H2O2溶液的相对初始速率随x变化的曲线如图所示。由图中信息可知:_ 法制取得到的催化剂活性更高;Co2+、Ni2+两种离子中催化效果较好的是_ 。
(3) CoCl2常用作多彩水泥的添加剂,可用钴的氧化物(其中Co的化合价为+2、+3)制备,用480 mL 5 mol·L-1盐酸恰好将其完全溶解,得到CoCl2溶液和6.72 L(标准状况下)黄绿色气体。则该钴的氧化物的化学式为_ 。
 口算小状元口算速算天天练系列答案
口算小状元口算速算天天练系列答案科目:高中化学 来源:2015-2016学年江苏省高二上学期期中必修化学试卷(解析版) 题型:选择题
设 NA为阿伏加德罗常数的数值,下列说法中错误的是
A.在标准状况下,22.4 L苯所含的碳原子数目为6NA
B.常温常压下,6.2g氧化钠含有的离子数为0.3NA
C.18 g 水所含的电子数目为10 NA
D.3.2g O2、O3混合物中所含S原子一定是0.2NA
查看答案和解析>>
科目:高中化学 来源:2016届辽宁省高三上学期第二次模拟测试化学试卷(解析版) 题型:选择题
实验研究发现,硝酸发生氧化还原反应时,硝酸的浓度越稀,对应还原产物中氮元素的化合价越低。现有一定量的铝粉和铁粉的混合物与一定量很稀的硝酸充分反应,反应过程中无气体放出。在反应结束后的溶液中逐滴加入5mol/L NaOH溶液,所加的NaOH溶液的体积(mL)与产生沉淀的物质的量(mol)关系如下图所示,下列说法不正确的是

A.稀硝酸与铝粉、铁粉反应,其还原产物为硝酸铵
B.图中C点对应溶液体积为48mL
C.原硝酸溶液中含硝酸的物质的量为0.5mol
D.样品中铝粉和铁粉的物质的量之比5:3
查看答案和解析>>
科目:高中化学 来源:2015-2016学年吉林实验中学高二上学期期中考试化学试卷(解析版) 题型:填空题
如下图是一个化学过程的示意图。已知甲池的总反应式为:2CH3OH+3O2+4KOH===2K2CO3+6H2O。

(1)甲池是________装置。
(2)乙池中A(石墨)电极的名称是________。
(3)写出通入CH3OH的电极的电极反应式:_________________________。
(4)乙池中反应的化学方程式为______________________________________。
(5)当乙池中B(Ag)极的质量增加5.40 g时,甲池中理论上消耗O2________ mL(标准状况);此时丙池某电极上析出0.60 g某金属,则丙池中的某盐溶液可能是________(填序号)。
A.MgSO4 B.CuSO4 C.NACl D.AgNO3
查看答案和解析>>
科目:高中化学 来源:2015-2016学年广东汕头金山中学高一10月月考化学试卷(解析版) 题型:选择题
下列溶液中,溶质的物质的量浓度为1 mol·L-1 的是
A.将80 g NaOH溶于2 L 水所得的溶液
B.将0.5 mol·L-1的NaNO3溶液100 mL 加热蒸发掉50 g水所得的溶液
C.将40 g NaOH 溶于水并配成1 L的溶液
D.含K+为4 mol·L-1的K2SO4溶液
查看答案和解析>>
科目:高中化学 来源:2015-2016河北石家庄第一中学高一上期中考试化学试卷(解析版) 题型:填空题
某一反应体系有反应物和生成物共六种微粒:O2、MnO4-、Mn2+、H+ 、H2O、H2O2。已知该反应中H2O2只发生如下过程:H2O2→ O2
(1)该反应中的还原剂是 。
(2)该反应中,发生还原反应的过程是 → 。
(3)写出且配平该反应的离子方程式,并标出电子转移的方向和数目
(4)如反应转移了0.3mol电子,则产生的气体在标准状况下体积为 L。
查看答案和解析>>
科目:高中化学 来源:2015-2016河北石家庄第一中学高二上期中考试化学试卷(解析版) 题型:实验题
实验室制备1,2-二溴乙烷的反应原理如下:

可能存在的主要副反应有:①乙醇在浓硫酸的存在下在l40℃脱水生成乙醚(CH3CH2OCH2CH3);②浓硫酸将乙醇脱水碳化。
用少量的溴和足量的乙醇制备1,2—二溴乙烷的装置如下图所示:

有关数据列表如下:
乙醇 | 1,2-二溴乙烷 | 乙醚 | |
状态 | 无色液体 | 无色液体 | 无色液体 |
密度/g · cm-3 | 0.79 | 2.2 | 0.71 |
沸点/℃ | 78.5 | 132 | 34.6 |
熔点/℃ | 一l30 | 9 | -1l6 |
回答下列问题:
(1)在此制各实验中,要尽可能迅速地把反应温度提高到170℃左右,其最主要目的是_____________;(填正确选项前的字母)
a.引发反应 b.加快反应速度 c.防止乙醇挥发 d.减少副产物乙醚生成
(2)在装置C中应加入____________,其目的是吸收反应中可能生成的酸性气体:(填
正确选项前的字母)
a.水 b.浓硫酸 c.氢氧化钠溶液 d.饱和碳酸氢钠溶液
(3)判断该制各反应已经结束的最简单方法是_____________________;
(4)将1,2-二溴乙烷粗产品置于分液漏斗中加水,振荡后静置,产物应在______层(填“上”、“下”);
(5)若产物中有少量未反应的Br2,最好用________洗涤除去;(填正确选项前的字母)
a.水 b.氢氧化钠溶液 c.碘化钠溶液 d.乙醇
(6)若产物中有少量副产物乙醚.可用_______________的方法除去;
(7)反应过程中应用冷水冷却装置D,其主要目的是____________;但又不能过度冷却(如用冰水),其原因是_____________________。
查看答案和解析>>
科目:高中化学 来源:2016届浙江省高三上学期期中考试化学试卷(解析版) 题型:选择题
金属-硫电池价格低廉,使用寿命较长,能量密度高,因而在电池研究领域得到广泛关注。最近,我国科研工作者研究了一种能在室温下工作的新型Na-S电池。该电池放电过程的总反应方程式如下:nS + 2Na = Na2Sn
注:能量密度指单位质量的电极材料可输出的电能,以W·h·kg-1为计量单位。
则下列说法不正确的是( )
A.该电池中用固态金属Na为负极,S单质作为正极,但S单质须负载在导电材料上
B.该电池的电解质必须具备室温下传导Na+的能力,但不宜用NaOH溶液作为电解液
C.n值越大则该电池的能量密度越高
D.该电池充电过程中阳极的电极反应式:Na2Sn-2e-=2Na+ + nS,故充电时Na+从阳极向阴极迁移
查看答案和解析>>
科目:高中化学 来源:2016届贵州遵义航天高级中学高三第四次模拟考试理化学卷(解析版) 题型:选择题
下列离子方程式书写正确的是( )
A. 苯酚钠溶液中通入少量二氧化碳气体: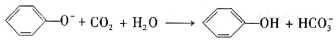
B. 金属铝溶于NaOH溶液:Al + 2OH- =AlO2- + H2↑
C. 澄清石灰水与过量小苏打溶液混合:Ca2+ + OH- + HCO3-=CaCO3↓+ H2O
D. NaHCO3的水解:HCO3- + H2O H3O+ + CO32-
H3O+ + CO32-
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com