



 阅读快车系列答案
阅读快车系列答案科目:高中化学 来源: 题型:
 环上的二溴取代物的种类有
环上的二溴取代物的种类有查看答案和解析>>
科目:高中化学 来源: 题型:
查看答案和解析>>
科目:高中化学 来源: 题型:
c(Co(H2O
| ||
c(CoC
|
查看答案和解析>>
科目:高中化学 来源: 题型:
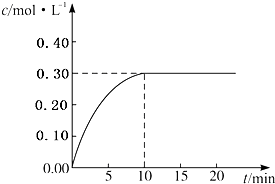 目前工业上通常用生产水煤气的方法获得,反应的化学方程为:CO(g)+H2O(g)?CO2(g)+H2(g)△H<0.若在某一容积为4L的密闭容器内,加入2.0mol的CO和3.0mol的H2O(g),在催化剂存在的条件下于850℃高温加热,发生上述反应,反应中CO2的浓度随时间变化情况如图所示:
目前工业上通常用生产水煤气的方法获得,反应的化学方程为:CO(g)+H2O(g)?CO2(g)+H2(g)△H<0.若在某一容积为4L的密闭容器内,加入2.0mol的CO和3.0mol的H2O(g),在催化剂存在的条件下于850℃高温加热,发生上述反应,反应中CO2的浓度随时间变化情况如图所示:查看答案和解析>>
科目:高中化学 来源: 题型:
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、溶液与胶体:本质不同的原因是能否发生丁达尔效应 |
| B、用托盘天平称得2.50 g胆矾,受热充分失水后,固体质量减轻0.90g |
| C、从1L 1mol?L-1的NaCl溶液中取出10 mL,其浓度仍是1mol?L-1 |
| D、10g 98%硫酸(密度为1.84 g/cm3)与10mL 18.4mol?L-1硫酸的浓度是不同的 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com