
【题目】某三元羧酸H3A在表面活性剂、洗涤剂、润滑剂等方面具有重要的地位。常温时,向10mL0.01mol·L-1的H3A溶液中滴入0.01mol·L-1的NaOH溶液,H3A、H2A-、HA2-、A3-的物质的量分数与溶液的pH的关系如图所示。则下列说法中错误的是( )

A.常温时,0.01mol·L-1的H3A溶液的pH介于2~3之间
B.常温时,反应A3-+H2O ![]() HA2-+OH-的平衡常数为K=10c-14
HA2-+OH-的平衡常数为K=10c-14
C.若b=7,则将等物质的量的NaH2A与Na2HA加入到适量蒸馏水中使其完全溶解,则所得的溶液的pH一定等于7
D.加入NaOH溶液的体积为30mL时,所得溶液中存在有:c(OH-)=3c(H3A)+2c(H2A-)+c(HA2-)+c(H+)
【答案】C
【解析】
由题意可知三元羧酸H3A是三元弱酸,在水中可电离出H2A-、HA2-、A3-。由图像可知在a点时有![]() ,在b点时有
,在b点时有![]() ,在c点时有
,在c点时有![]() 。
。
A.常温时,依据题目所给图像可以得出0.01mol·L1的H3A溶液中约有30%的电离,即溶液中氢离子的浓度约为0.003mol·L1,pH=-lg0.003![]() 2.5,故pH介于2~3之间,A正确,不选;
2.5,故pH介于2~3之间,A正确,不选;
B.A3-的水解平衡常数![]() ,在c点时有
,在c点时有![]() ,且pH=c,故
,且pH=c,故![]() ,B正确,不选;
,B正确,不选;
C.将等物质的量的NaH2A与Na2HA加入到适量蒸馏水中完全溶解,则所得的溶液中H2A与HA2的浓度不一定相等, C错误,符合题意;
D.当加入NaOH溶液的体积为30mL时,此时的物料守恒表达式为:![]() ,而电荷守恒表达式为:
,而电荷守恒表达式为:![]() ,两式联立可得c(OH-)=3c(H3A)+2c(H2A-)+c(HA2-)+c(H+),D正确,不选;
,两式联立可得c(OH-)=3c(H3A)+2c(H2A-)+c(HA2-)+c(H+),D正确,不选;
答案选C。


 优等生题库系列答案
优等生题库系列答案科目:高中化学 来源: 题型:
【题目】(变式探究)在含有a g HNO3的稀硝酸中,加入b g铁粉充分反应,铁全部溶解并生成NO,有a/4 g HNO3被还原,则a∶b不可能为 ( )
A. 2∶1 B. 3∶1 C. 4∶1 D. 9∶2
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列叙述正确的是( )
A.室温下,pH=3的CH3COOH溶液与pH=11的NaOH溶液等体积混合,所得溶液pH>7
B.室温下,Na2CO3溶液中加入少量Ca(OH)2固体,溶液中![]() 的值增大
的值增大
C.在外加电流的阴极保护法中,须将被保护的钢铁设备与直流电源的负极相连
D.反应NH3(g)+HCl(g)=NH4Cl(s)在室温下能自发进行,该反应的ΔH>0
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】有甲乙两位同学均想利用原电池反应检测金属的活动性顺序,两人均使用镁片和铝片作电极,但甲同学将电极放入 6mol/L 的硫酸溶液,乙同学将电极放入 6mol/L 的氢氧化钠溶液中,如图所示:
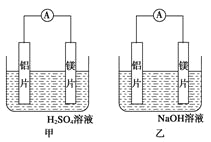
(1)写出甲电池中正极的电极反应式___________________ ;
(2)写出乙池中负极的电极反应式: 负极:_____ 总反应的离子方程式:_________
(3)如果甲与乙同学均认为“构成原电池的电极材料如果都是金 属,则构成负极材料的金属活泼
,则甲会判断出_____活动性更强,而乙会判断出_____活动性更强(填名称)
(4)由此实验,可得到如下哪些正确结论(_____)
a. 利用原电池反应判断金属活动性顺序时应注意选择合适的介质
b. 镁的金属性不一定比铝的强
c. 该实验说明金属活动性顺序表已过时,已没有利用价值
d. 该实验说明化学研究对象复杂,反应受条件影响较大,因此应具体问题具体分析
(5)上述实验也反过来证明了“直接利用金属活动性顺序表判断原电池中的正负极”这种做法__填 “可靠”或“不可靠”)。如不可靠,请你提出另一个判断原电池正负极的可行实验方案_______________ (如 可靠,可不填)
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】把0.4molX气体和0.6molY气体混合于2L密闭容器中,使它们发生如下反应:4X(g)+5Y(g) ![]() nZ(g)+6W(g)。2min末已生成0.3molW,若测知以Z的浓度变化表示的反应速率为0.05mol/(L·min),试计算
nZ(g)+6W(g)。2min末已生成0.3molW,若测知以Z的浓度变化表示的反应速率为0.05mol/(L·min),试计算
(1)前2min内用W的浓度变化表示的平均反应速率为_______________。
(2)2min末时Y的浓度为_____________________________。
(3)化学反应方程式中n=_____________________________。
(4)2min末,恢复到反应前温度,体系内压强是反应前压强的__________倍。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】支撑海港码头基础的钢管桩,常用外加电流的阴极保护法进行防腐,工作原理如图所示,下列有关表述错误的是( )
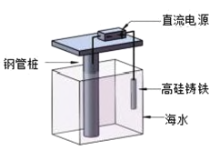
A.利用了电解原理B.电子由电源负极流向钢管桩
C.钢管桩是负极D.高硅铸铁作阳极
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】![]() 、
、![]() 、
、![]() 、
、![]() 为短周期元素,其原子半径、化合价等信息见下表。以下说法一定正确的是( )
为短周期元素,其原子半径、化合价等信息见下表。以下说法一定正确的是( )
元素 |
|
|
|
|
原子半径( | 0.077 | 0.070 | 0.104 | 0.099 |
最高正价或最低负价 | +4 | +5 | -2 | -1 |
A.![]() 与
与![]() 形成的化合物的电子式可表示为
形成的化合物的电子式可表示为![]()
B.![]() 的氢化物能与
的氢化物能与![]() 的氢化物反应,所得产物只含有共价键
的氢化物反应,所得产物只含有共价键
C.![]() 、
、![]() 能分别与氧元素形成多种氧化物
能分别与氧元素形成多种氧化物
D.![]() 处于元素同期中第三周期ⅣA族
处于元素同期中第三周期ⅣA族
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某海水中主要离子的含量如下表,现利用“电渗析法”进行淡化,技术原理如图所示(两端为惰性电极,阳膜只允许阳离子通过,阴膜只允许阴离子通过)。下列有关说法错误的是( )
离子 |
|
|
|
|
|
|
|
含量 | 9360 | 83 | 200 | 1100 | 16000 | 1200 | 118 |
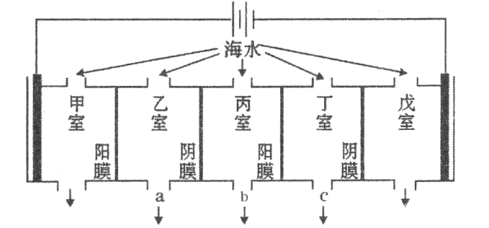
A.甲室的电极反应式为:![]()
B.乙室和丁室中部分离子的浓度增大,淡水的出口为b
C.当戊室收集到![]() (标准状况)气体时,通过甲室阳膜的离子的物质的量一定为
(标准状况)气体时,通过甲室阳膜的离子的物质的量一定为![]()
D.淡化过程中易在戊室形成水垢
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】如图所示,甲、乙两池电极材料都是铁棒和碳棒,请回答下列问题:
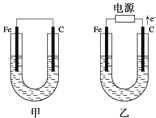
(1)若两池中电解质溶液均为CuSO4溶液,则反应一段时间后:
①有红色物质析出的是甲池中的___棒,乙池中的___棒。
②乙池中阳极的电极反应式是___。
(2)若两池中电解质溶液均为饱和NaCl溶液:
①写出乙池中总反应的离子方程式___。
②甲池中碳极上电极反应式是___,乙池碳极上电极反应属于___(填“氧化反应”或“还原反应”)。
③将湿润的KI淀粉试纸放在乙池碳极附近,发现试纸变蓝,反应的化学方程式为___。
④若乙池转移0.02mole﹣后停止实验,池中电解质溶液体积是200mL,则溶液混合均匀后的pH=___。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com