
【题目】下面列举的是某化合物的组成和性质,能说明该物质肯定是有机物的是( )
A.仅由碳、氢两种元素组成
B.仅由碳、氢、氧三种元素组成
C.在氧气中燃烧只生成二氧化碳
D.熔点低而且难溶于水
 长江作业本同步练习册系列答案
长江作业本同步练习册系列答案 小天才课时作业系列答案
小天才课时作业系列答案科目:高中化学 来源: 题型:
【题目】下列条件下,两瓶气体所含的原子数一定相等的是( )
①同质量、不同密度的Cl2和CO ②同温度、同体积的H2和 N2
③同体积、同密度的 C2H4和C3H6两种气体 ④同压强、同体积的N2O 和 CO2两种气体.
A.①③
B.③
C.③④
D.②④
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】到目前为止,由化学能转变的热能或电能仍然是人类使用的最主要的能源.
(1)在25℃、101kPa下,8g的甲醇(CH3OH)完全燃烧生成CO2和液态水时放出176kJ的热量,则表示甲醇燃烧热的热化学方程式为 .
(2)化学反应中放出的热能(焓变,△H)与反应物和生成物的键能(E)有关.
已知:H2 (g)+Cl2 (g)=2HCl (g)△H=﹣185kJ/mol
E(H﹣H)=436kJ/mol E(Cl﹣Cl)=243kJ/mol
则E(H﹣Cl)= ,
(3)CuCl(s)与O2反应生成CuCl2(s)和一种黑色固体.在25℃、101kPa下,已知该反应每消耗1mol CuCl(s),放热44.4kJ,该反应的热化学方程式是 .
(4)FeCO3在空气中加热反应可制得铁系氧化物材料.
已知25℃,101kPa时:4Fe(s)+3O2(g)=2Fe2O3(s)△H=﹣1648kJ/mol
C(s)+O2(g)=CO2(g)△H=﹣393kJ/mol
2Fe(s)+2C(s)+3O2(g)=2FeCO3(s)△H=﹣1480kJ/mol
FeCO3在空气中加热反应生成Fe2O3的热化学方程式是 .
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】电解质溶液与人类生活息息相关,请回答下列问题
(1)某温度下,Kw=1×10﹣12( molL﹣1)2 , 若保持温度不变,向水中滴入稀硫酸恰好使溶液中c(H+)/c(OH﹣)=1×1010 , 则此时水电离出的c(H+)=molL﹣1 .
(2)常温下若溶液由pH=3的HA溶液V1 mL与pH=11的NaOH溶液V2 mL混合而得,则下列说法正确的是 .
A.若混合后溶液呈中性,则c(H+)+c(OH﹣)=2×10﹣7mol/L
B.若V1=V2 , 混合后溶液的pH一定等于7
C.若混合后溶液呈酸性,则V1一定大于V2
D.若混合后溶液呈碱性,则V1一定小于V2
(3)下列曲线中,可以描述乙酸(甲,Ka=1.8×10﹣5 mol/L)和一氯乙酸(乙,Ka=1.4×10﹣3 mol/L)在水中的电离度与浓度关系的是 
(4)在下列实验中,能证明醋酸酸性比盐酸酸性弱的是 .
A.将等体积、pH=4的盐酸和醋酸稀释成pH=5的溶液,测量所需加入水量的多少
B.向等体积、等pH的盐酸和醋酸中分别加入同量的相应钠盐固体,测溶液的pH有无变化
C.向等体积、等浓度的盐酸和醋酸分别加入足量锌粉,测量产生氢气的体积
D.用等体积、等浓度的盐酸和醋酸做导电性实验,根据灯泡的明亮程度.
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】如图是部分短周期元素的原子序数与其某种常见化合价的关系图,若用原子序数代表所对应的元素,则下列说法正确的是( ) 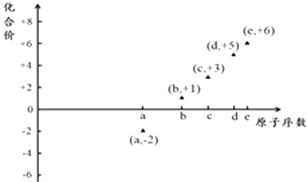
A.31d和33d属于同种核素
B.气态氢化物的稳定性:a>d>e
C.工业上常用电解法制备单质b和c
D.a和b形成的化合物不可能含共价键
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】可逆反应C(s)+H2O(g)H2(g)+CO(g),△H>0达到平衡后,改变某一外界条件(不改变物质的量的条件下),反应速率v与时间t的关系如图. 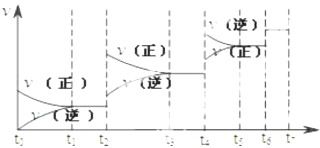
①图中t2到t3段、t4到t6段时引起平衡移动的条件分别可能是、;
②图中表示平衡混合物中CO的含量最高的一段时间是 .
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列叙述中,正确的是 ( )
A. 由共价键形成的物质一定是共价化合物
B. 只有金属元素和非金属元素化合时才能形成离子键
C. 分子中不一定存在化学键
D. 共价化合物可能含离子键,离子化合物可能含共价键
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】已知常温下,HA的电离平衡常数Ka=6.25×10﹣5 , H2CO3的电离平衡常数Ka1=4.17×10﹣7、Ka2=4.90×10 ﹣11 . 在生产碳酸饮料的过程中,除了添加NaA外,还需加压充入CO2气体.下列说法不正确的是(不考虑饮料中其他成分)( ) A.相同物质的量浓度的Na
A.HA混合溶液呈碱性
B.提高CO2兖气压力,碳酸饮料中c (A﹣)减小
C.当碳酸饮料的pH为5.0时, ![]() =0.16
=0.16
D.碳酸饮料中各粒子的浓度关系为c( H+)=c( HCO3﹣)+2c( CO32﹣)+c(OH﹣)﹣c(HA)
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】如图所示,C、D、E、F、X、Y都是惰性电极,甲、乙中溶液的体积和浓度都相同(假设通电前后溶液体积不变),A、B为外接直流电源的两极.将直流电源接通后,丁中X极附近的颜色逐渐变浅,Y极附近的颜色逐渐变深.请回答: 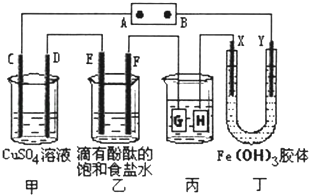
(1)若甲、乙装置中的C、D、E、F电极均只有一种单质生成时,对应单质的物质的量之比为 .
(2)现用丙装置给铜件镀银,当乙中溶液的pH是13时(此时乙溶液体积为500mL),丙中镀件上析出银的质量为 .
(3)Fe(OH)3胶体的制备有严格的要求,小明想向FeCl3溶液中滴加NaOH溶液来制备Fe(OH)3胶体,结果很快就生成了红褐色的沉淀.他测得溶液的pH=5,则此时溶液中c(Fe3+)=mol/L.(己知Ksp=1×10﹣36).
(4)若用甲烷燃料电池(电解质溶液为2L2mol/LKOH溶液)提供电源,持续通入甲烷,在标准状况下,消耗甲烷的体积VL.当消耗CH4的体积在44.8<V≤89.6时,此时电源中B极发生的电极反应为: .
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com