目前,“低碳经济”备受关注,CO
2的产生及有效开发利用成为科学家研究的重要课题.
(1)向浓CaCl
2溶液中通入NH
3和CO
2,可以制得纳米级碳酸钙(粒子直径在1?10nm之间).①向浓CaCl
2溶液中通人NH
3和CO
2气体制纳米级碳酸钙时,应先通入NH
3,后通 入C0
2.制备纳米级碳酸钙的离子方程式为
②判断产品中是否含有纳米级碳酸钙的实验方法为
.
(2)-定条件下,C(s)和H
2O(g)反应,能生成C0
2(g)和H
2(g).将C(s)和H
20(g)分别 加入甲、乙两个密闭容器中,发生反应:C(s)+2H
20(g)?C0
2(g)+2H
2(g),其相关数 据如下表所示:
| 容器 |
容积/L |
温度/℃ |
起始量/mol |
平衡量/mol |
达到平衡所需时间/min |
| C(s) |
H2O(g) |
H2(g) |
| 甲 |
2 |
T1 |
2 |
4 |
3.2 |
8 |
| 乙 |
1 |
T2 |
1 |
2 |
1.2 |
3 |
①T
1℃时,该反应的平衡常数K=
②乙容器中,当反应进行到1.5min时,H
2O(g)的物质的量浓度
(填选项字母).
A.=0.8mol/L B.=1.4mol/L C.<1.4mol/L D.>1.4mol/L
③丙容器的容积为1L,T
2℃时,起始充入a mol CO
2和b mol H
2(g),反应达到平衡时,测得CO
2的转化率大于H
2的转化率,则
的值需满足的条件为
;
④丁容器的容积为1L,T
1℃时,按下列配比充入C(s)、H
2O(g)、CO
2(g)和H
2(g),达到平衡时各气体的体积分数与甲容器完全相同的是
(填选项字母).
A.0.6mol、1.0mol、0.5mol、1.0mol
B.0.6mol、2.0mol、O mol、O mol
C.1.0mol、2.0mol、1.0mol、2.0mol
D.0.25mol、0.5mol、0.75mol、1.5mol
(3)CO
2在一定条件下可转化为甲醚(CH
3OCH
3).用甲醚燃料电池做电源,用惰性电极电 解饱和K
2SO
4溶液可制取H
2SO
4和KOH,实验装置如图所示

①甲醚燃料电池的负极反应式为
②A口导出的物质为
(填化学式).
③若燃料电池通入CH
3OCH
3(g)的速率为0.1mol?min
-1,2min时,理论上C 口收集 到标准状况下气体的体积为
.




 期末100分闯关海淀考王系列答案
期末100分闯关海淀考王系列答案 小学能力测试卷系列答案
小学能力测试卷系列答案 Na2CO3是一种很重要的化学物质,某学生拟在实验室中制备Na2CO3.下面是他的制备实验过程:用50mL NaOH溶液吸收CO2气体,制备Na2CO3溶液.为了防止通入的CO2气体过量,生成NaHCO3,他设计了如下实验步骤:
Na2CO3是一种很重要的化学物质,某学生拟在实验室中制备Na2CO3.下面是他的制备实验过程:用50mL NaOH溶液吸收CO2气体,制备Na2CO3溶液.为了防止通入的CO2气体过量,生成NaHCO3,他设计了如下实验步骤: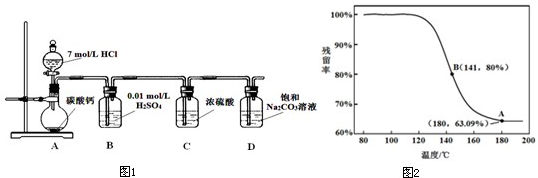


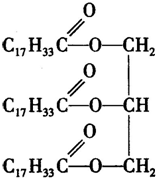 试从某油脂结构简式,分析它可能发生的化学反应:
试从某油脂结构简式,分析它可能发生的化学反应: