
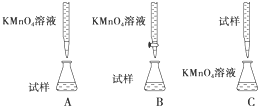
分析 方案一:(1)精确配制一定物质的量浓度的KMnO4溶液250mL,配制时需要的仪器有天平、药匙、玻棒、烧杯、胶头滴管、250mL容量瓶;
(2)酸化KMnO4溶液的酸本身不能具有还原性,如果有还原要被高锰酸钾氧化,本身也不能具有强氧化性,所以只能选硫酸;
(3)酸性溶液或强氧化性溶液应用酸式滴定管;
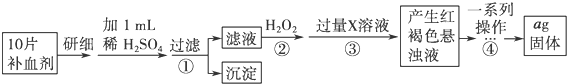
方案二:由流程图可知,该实验原理为:将药品中的Fe2+形成溶液,将Fe2+氧化为Fe3+,使Fe3+转化为氢氧化铁沉淀,再转化为氧化铁,通过测定氧化铁的质量,计算补血剂中铁元素的含量;
(4)Fe2+与碱反应后不能保证Fe2+全部转化为Fe3+,加热不能得到纯净的Fe2O3,故无法准确计算Fe的含量;
(5)步骤④中一系列处理是由氢氧化铁悬浊液最终转化为氧化铁,需要过滤、洗涤的氢氧化铁,然后灼烧生成氧化铁,冷却后称量氧化铁的质量;
(6)根据铁元素守恒可知ag氧化铁中铁元素的质量即为10片补血剂中铁的质量,据此计算.
解答 解:方案一:(1)精确配制一定物质的量浓度的KMnO4溶液250mL,配制时需要的仪器有天平、药匙、玻棒、烧杯、胶头滴管、250mL容量瓶;
故答案为:250mL容量瓶;
(2)酸化KMnO4溶液的酸本身不能具有还原性,如果有还原性要被高锰酸钾氧化,本身也不能具有强氧化性,所以只能选硫酸,故答案为:A;
(3)酸性溶液或强氧化性溶液应用酸式滴定管,故答案为:B;
方案二:由流程图可知,该实验原理为:将药品中的Fe2+形成溶液,将Fe2+氧化为Fe3+,使Fe3+转化为氢氧化铁沉淀,再转化为氧化铁,通过测定氧化铁的质量,计算补血剂中铁元素的含量.
(4)Fe2+与碱反应后不能保证Fe2+全部转化为Fe3+,加热不能得到纯净的Fe2O3,故无法准确计算Fe的含量,故步骤②不能省略;
故答案为:不能,Fe2+与碱反应后不能保证Fe2+全部转化为Fe3+,加热不能得到纯净的Fe2O3,故无法准确计算Fe的含量;
(6)ag氧化铁中铁元素的质量即为10片补血剂中铁的质量,所以每片补血剂含铁元素的质量=$\frac{ag×\frac{112}{160}}{10}$=0.07ag;
故答案为:0.07a;
点评 本题考查学生对实验原理与实验操作的理解、物质分离提纯、元素化合物性质、氧化还原反应滴定、化学计算等,难度中等,清楚实验原理是解题的关键,需要学生具备扎实的基础知识与综合运用知识分析问题、解决问题的能力.


科目:高中化学 来源: 题型:推断题
查看答案和解析>>
科目:高中化学 来源: 题型:计算题
 将0.1mol的镁、铝混合物溶于100mL、2mol•L-1的H2SO4溶液中,然后再滴加1mol•L-1的NaOH溶液.请回答:
将0.1mol的镁、铝混合物溶于100mL、2mol•L-1的H2SO4溶液中,然后再滴加1mol•L-1的NaOH溶液.请回答:查看答案和解析>>
科目:高中化学 来源: 题型:选择题
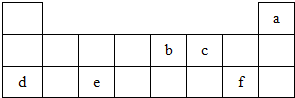
 X、Y、Z、W均为短周期元素,它们在元素周期表中相对位置如图所示.若Z原子的最外层电子数是第一层电子数的3倍,下列说法中正确的是( )
X、Y、Z、W均为短周期元素,它们在元素周期表中相对位置如图所示.若Z原子的最外层电子数是第一层电子数的3倍,下列说法中正确的是( )| A. | X的气态氢化物的水溶液显酸性 | |
| B. | X的原子半径小于Y | |
| C. | Z的最外层电子数比Y多 | |
| D. | W的单质能与水反应,生成一种具有漂白性的物质 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 羟基的电子式: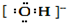 | B. | CH4分子的球棍模型: | ||
| C. | 乙烯的最简式:CH2 | D. | 氟离子的结构示意图: |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 某主族元素的最高价含氧酸为HnROm,则其气态氢化物一般是H2m-nR | |
| B. | 除第ⅡA族族外,其余各族都有非金属元素 | |
| C. | 同一主族相邻的两种元素的原子序数之差可能为16 | |
| D. | 同一短周期元素的原子半径从左到右逐渐减小 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | NH4CNO与尿素CO(NH2)2 | |
| B. | H2O与D2O | |
| C. | Si(OH)4与H4SiO4 | |
| D. | [Cr(H2O)5Cl]Cl2•H2O与[Cr(H2O)4Cl2]Cl•2H2O |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com