
| A. | 钠与硫酸铜溶液反应会置换出红色的铜 | |
| B. | 常温下干燥氯气与铁不反应,可以用钢瓶储存液氯 | |
| C. | CO2、NO2、SO2都能与H2O反应,其反应原理相同 | |
| D. | C、N、S三种单质直接与O2反应都能生成两种氧化物 |
分析 A.钠与硫酸铜溶液反应,钠先与水反应生成氢氧化钠与氢气,氢氧化钠继续与硫酸铜反应生成氢氧化铜和硫酸钠;
B.液氯为氯气的液态,不与铁反应;
C.二氧化氮和水反应属于氧化还原反应;
D.氮气和氧气反应生成NO,硫在氧气中燃烧生成二氧化硫;
解答 解:A.钠与硫酸铜溶液反应,钠先与水反应生成氢氧化钠与氢气,氢氧化钠继续与硫酸铜反应生成氢氧化铜和硫酸钠,所以钠与硫酸铜溶液反应会生成氢氧化铜、氢气和硫酸钠,不会置换出铜,故A错误;
B.液氯为氯气的液态,不与铁反应,所以可以用钢瓶储存液氯,故B正确;
C.CO2+H2O=H2CO3、SO2+H2O=H2SO3中没有电子转移属于非氧化还原反应,3NO2+H2O=2HNO3+NO中有电子转移属于氧化还原反应,故C错误;
D.氮气和氧气反应生成NO,S在氧气中燃烧生成二氧化硫,则N、S单质直接与O2反应只能生成一种氧化物,故D错误;
故选B;
点评 本题考查元素及其化合物的性质,涉及液氯的储存、氧化还原反应的判断等知识点,熟练掌握Na、N、S、Cl元素及其化合物性质并灵活运用,为高考高频点,题目难度不大;


科目:高中化学 来源: 题型:填空题
| 元素 | A | B | C | D | E |
| 性质 或结 构信 息 | 室温下单质呈气态,原子最外层电子数与D相同 | D3B中阳离子与阴离子的电子层结构相同 | A和C可形成两种常见的化合物甲和乙,甲有强氧化性 | 单质质软、银白色固体、导电性强,在空气中燃烧生成淡黄色固体 | E的气态氢化物和最高价氧化物对应的水化物均为强酸,C、D和E三种元素形成的一种盐丙为某消毒液的主要成分 |
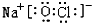 .丙在水溶液中的电离方程式NaClO=Na++ClO-.
.丙在水溶液中的电离方程式NaClO=Na++ClO-.查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | K层电子数为偶数的所有元素所在族的序数与该元素原子的K层电子数相等 | |
| B. | L层电子数为奇数的所有主族元素所在族的序数与该元素原子的L层电子数相等 | |
| C. | L层电子数为偶数的所有主族元素所在族的序数与该元素原子的L层电子数相等 | |
| D. | M层电子数为偶数的所有主族元素所在族的序数与该元素原子的M层电子数相等 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | n+11 | B. | n-5 | C. | n+3 | D. | n-6 |
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
 ,该化合物属于离子化合物.
,该化合物属于离子化合物.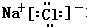 、
、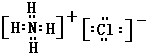 .
.查看答案和解析>>
科目:高中化学 来源: 题型:填空题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 通常状况下,氨气的溶解度较大 | |
| B. | 氨水中的NH3•H2O电离出少量的OH- | |
| C. | 溶于水的氨气生成的少量NH3•H2O全部电离生成OH- | |
| D. | 氨气本身的碱性弱 |
查看答案和解析>>
科目:高中化学 来源: 题型:多选题
| A. | NiMH 电池放电过程中,正极的电极反应式为:NiOOH+H2O+e-=Ni(OH)2+OH- | |
| B. | 充电过程中OH-离子从阳极向阴极迁移 | |
| C. | 充电过程中阴极的电极反应式:H2O+M+e-=MH+OH-,H2O中的H被M还原 | |
| D. | 放电是OH-离子从正极向负极迁移 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | NaHSO4溶于水:NaHSO4?Na++H++SO42- | |
| B. | 次氯酸电离:HClO═ClO-+H+ | |
| C. | HF溶于水:HF+H2O?H3O++F- | |
| D. | NH4Cl溶于水:NH4++H2O?NH3•H2O+H+ |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com