
| A. | 氧化剂与还原剂的物质的量之比为2:1 | |
| B. | 该反应可能在酸性条件下进行 | |
| C. | 反应物微粒是S、SO32-、OH- | |
| D. | .2molS参加反应时,转移的电子数为$\frac{8}{3}$ NA |
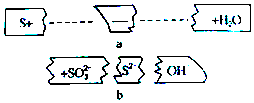
分析 碱性条件下,S与氢氧根离子反应生成S2-和SO32-,反应反应的离子方程式为:3S+6OH-=2S2-+SO32-+3H2O,反应中部分S的化合价从0价升高到+4价,部分S的化合价从0价降低到-2价,据此分析.
解答 解:碱性条件下,S与氢氧根离子反应生成S2-和SO32-,反应反应的离子方程式为:3S+6OH-=2S2-+SO32-+3H2O,反应中部分S的化合价从0价升高到+4价,部分S的化合价从0价降低到-2价,
A.化合价降低的硫作氧化剂,化合价升高的S作还原剂,则氧化剂与还原剂的物质的量之比为1:2,故A错误;
B.酸性条件下,不能有OH-参加或生成,故B错误;
C.反应物微粒是S、OH-,故C错误;
D.反应中3molS转移4mol电子,则2molS参加反应时,转移的电子为$\frac{2mol×4mol}{3mol}$=$\frac{8}{3}$mol,则电子数为=$\frac{8}{3}$ NA,故D正确.
故选D.
点评 本题考查了离子反应和氧化还原反应的有关计算,题目难度中等,注意把握硫及其化合物的性质,侧重于考查学生的分析能力和计算能力.


科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 属于酯类的有4种 | |
| B. | 属于羧酸的有2种 | |
| C. | 存在有能使溴的四氯化碳溶液褪色的同分异构体 | |
| D. | 存在分子中含有五元环的酯类化合物 |
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
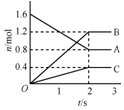 某温度下,在体积为5L的容器中,A、B、C三种物质物质的量随着时间变化的关系如图所示,则该反应的化学方程式为2A?3B+C,2s内用A的浓度变化的平均反应速率为0.08mol/(L•s).
某温度下,在体积为5L的容器中,A、B、C三种物质物质的量随着时间变化的关系如图所示,则该反应的化学方程式为2A?3B+C,2s内用A的浓度变化的平均反应速率为0.08mol/(L•s).查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 只根据反应NH3(g)+HCl(g)═NH4Cl(s)在低温下能自发进行,不能判断出该反应△H的正负 | |
| B. | 对于反应N2(g)+3H2(g)$?_{催化剂}^{高温、高压}$2NH3(g),加入更多的催化剂会使平衡向正反应方向移动 | |
| C. | 向纯水中加入盐酸能使水的电离平衡逆向移动,但水的离子积不变 | |
| D. | 用惰性电极电解1 L 1 mol/L的CuSO4溶液,当阴极析出3.2 g铜时,加入0.05 mol Cu(OH)2固体可将溶液恢复至原浓度 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
| 开始沉淀的pH | 完全沉淀的pH | |
| Ni2+ | 6.2 | 8.6 |
| Fe2+ | 7.6 | 9.1 |
| Fe3+ | 2.3 | 3.3 |
| Cr2+ | 4.5 | 5.6 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题

查看答案和解析>>
科目:高中化学 来源: 题型:推断题
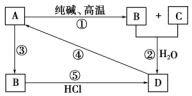 已知A是一种装饰品的主要成分,根据如图转化关系,回答下列问题.
已知A是一种装饰品的主要成分,根据如图转化关系,回答下列问题.查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com