
| A. | c(CH3COO-)>c(Na+) | B. | c(CH3COO-<c(Na+) | ||
| C. | c(CH3COO-)=c(Na+) | D. | 无法确定c(CH3COO-)与c(Na+)的关系 |
分析 常温下,将醋酸和氢氧化钠溶液混合,所得溶液pH=7,则溶液中满足:c(OH-)=c(H+),任何溶液中都存在电荷守恒,根据电荷守恒判断.
解答 解:常温下,混合溶液的pH=7,则溶液中满足:c(OH-)=c(H+),
任何溶液中都存在电荷守恒,根据电荷守可知:c(CH3COO-)+c(OH-)=c(H+)+c(Na+),
所以溶液中离子浓度关系为:c(CH3COO-)=c(Na+),故C正确,
故选C.
点评 本题考查了离子浓度大小比较,题目难度中等,根据溶液酸碱性再结合电荷守恒判断即可,注意任何溶液中都存在电荷守恒和物料守恒,与溶液酸碱性无关,为易错点,试题培养了学生的分析能力及灵活应用基础知识的能力.


 天天向上一本好卷系列答案
天天向上一本好卷系列答案 小学生10分钟应用题系列答案
小学生10分钟应用题系列答案科目:高中化学 来源: 题型:解答题
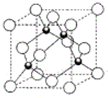 原子序数小于36的X、Y、Z、W四种元素,其中X是宇宙中最丰富的元素,Y原子基态时最外层电子数是其内层电子数的2倍,Z原子基态时2p原子轨道上有3个未成对的电子,W的原子序数为29.
原子序数小于36的X、Y、Z、W四种元素,其中X是宇宙中最丰富的元素,Y原子基态时最外层电子数是其内层电子数的2倍,Z原子基态时2p原子轨道上有3个未成对的电子,W的原子序数为29.查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | pH=1的无色溶液:Na+、Cu2+、NO3-、SO42- | |
| B. | 能使碘化钾淀粉试纸变蓝的溶液:K+、Fe2+、SO42-、Cl- | |
| C. | 使酚酞变红的溶液:Ba2+、Na+、Cl-、NO3- | |
| D. | 能溶解Al(OH)3固体的溶液:K+、Na+、HCO3--、NO3-- |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
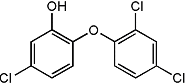 三氯生化学名为2,4,4-三氯-2羟基-二苯醚,被广泛应用于肥皂、牙膏等日用化学品之中,有杀菌消毒等作用.则下列有关说法中不正确的是( )
三氯生化学名为2,4,4-三氯-2羟基-二苯醚,被广泛应用于肥皂、牙膏等日用化学品之中,有杀菌消毒等作用.则下列有关说法中不正确的是( )| A. | 物质的分子式为C12H7Cl3O2 | |
| B. | 该物质苯环上的一溴取代物有6种 | |
| C. | 该物质中含有四种官能团 | |
| D. | 该物质中所有原子都可能处于同一平面 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | Al→Al2O3→Al(OH)3→Na[Al(OH)4] | B. | N2→NO→NO2→HNO3 | ||
| C. | Si→SiO2→H2SiO3→Na2SiO3 | D. | S→SO3→H2SO4→MgSO4 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
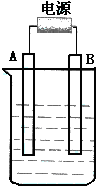 如图用石墨作电极的电解池中,放入500mL含一种溶质的某蓝色溶液进行电解,观察到A电极表面有红色的固态物质生成,B电极有无色气体生成;当溶液中的原有溶质完全电解后,停止电解,取出A电极,洗涤、干燥、称量、电极增重1.6g,请回答下列问题:
如图用石墨作电极的电解池中,放入500mL含一种溶质的某蓝色溶液进行电解,观察到A电极表面有红色的固态物质生成,B电极有无色气体生成;当溶液中的原有溶质完全电解后,停止电解,取出A电极,洗涤、干燥、称量、电极增重1.6g,请回答下列问题:查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | c(A-)>c(B+)>c(H+)>c(OH-) | B. | c(B+)>c(A-)>c(OH-)>c(H+) | ||
| C. | c(B+)+c (H+)>c(A-)+c(OH-) | D. | c(B+)>c(A-)>c(H+)>c(OH-) |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | Ca(HCO2)2溶液中加入过量NaOH溶液Ca2++HCO${\;}_{3}^{-}$+OH-═CaCO3↓+H2O | |
| B. | 酸性条件下KIO3溶液与KI溶液反应IO${\;}_{3}^{-}$+5I-+3H2O═3I2+6OH- | |
| C. | AlCl3溶液中加入少量Na 2Al3++6Na+6H2O═2Al(OH)3↓+6Na++3H2↑ | |
| D. | FeBr2溶液中通入少量Cl2 2Fe2++4Br+3Cl2→2Fe3++2Br2+6Cl- |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
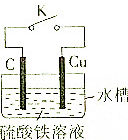 某同学为了探究原电池原理,设计如图所示装置:
某同学为了探究原电池原理,设计如图所示装置:查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com