
(1)25 ℃时,0.1 mol·L-1NaOH溶液的pH为________;
(2)25 ℃时,0.1 mol·L-1NH4Cl溶液的pH________7(填“<”、“=”或“>”),其原因是__________________(用离子方程式表示);
(3)将上述两种溶液等体积混合后,离子浓度大小次序正确的是________(填序号)。
A.[Na+]>[Cl-]>[OH-]>[H+]
B.[Na+]=[Cl-]>[H+]>[OH-]
C.[Na+]=[Cl-]>[OH-]>[H+]
D.[Cl-]>[Na+]>[OH-]>[H+]
(4)25 ℃时,0.1 mol·L-1NaOH溶液中水电离出来的氢氧根的浓度为C1,0.1 mol·L-1NH4Cl溶液中水电离出来的氢离子的浓度为C2,则C1 ______C2(填“<”、“=”或“>”)
(1)13 (2)< NH4++H2O NH3·H2O+H+ (3)C (4)<
NH3·H2O+H+ (3)C (4)<
【解析】
试题分析:(1)求溶液的pH,就是求溶液中氢离子浓度的负对数,25 ℃时,0.1 mol·L-1NaOH溶液的氢氧根离子浓度为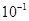 ,那么氢离子浓度就为
,那么氢离子浓度就为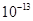 ,所以其pH=13 (2)氯化铵是强酸弱碱盐,水解显酸性,因此其pH<7,可以用以下方程式表示: NH4++H2O
,所以其pH=13 (2)氯化铵是强酸弱碱盐,水解显酸性,因此其pH<7,可以用以下方程式表示: NH4++H2O NH3·H2O+H+ (3)上述两种溶液等体积混合后,得到等物质的量的氨水和氯化钠,因此有C;(4)25 ℃时,0.1 mol·L-1NaOH溶液中水电离出来的氢氧根的浓度为C1=
NH3·H2O+H+ (3)上述两种溶液等体积混合后,得到等物质的量的氨水和氯化钠,因此有C;(4)25 ℃时,0.1 mol·L-1NaOH溶液中水电离出来的氢氧根的浓度为C1=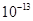 ;0.1 mol·L-1NH4Cl溶液中水电离出来的氢离子的浓度为C2=
;0.1 mol·L-1NH4Cl溶液中水电离出来的氢离子的浓度为C2=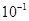 ,,则C1 <C2。
,,则C1 <C2。
考点:考查溶液的酸碱性。


科目:高中化学 来源: 题型:
查看答案和解析>>
科目:高中化学 来源:2011-2012学年海南省海南中学高二上学期期末考试理科化学试卷(带解析) 题型:填空题
(10分)在一定温度下,醋酸溶液存在电离平衡:
CH3COOH  CH3COO- + H+
CH3COO- + H+
(1)某温度时,0.1mol/L的醋酸溶液中的c(H+) 与0.01mol/L c(H+)的比值 _________________(填“大于”、“小于”或“等于”)10
(2)已知:25℃时,该电离平衡的平衡常数为1.75×10-5
①求该温度时,amol/L的醋酸溶液中c1(H+)="________________mol/L" (用含a的代数式表示)。[提示:此时a比较小,进行简化计算,平衡时c(CH3COOH)可用初始浓度代替,水电离出的c(H+) 、c(OH-)忽略不计,下同]
②若该温度时向该溶液中加入一定量的CH3COONH4(假设溶液体积不变),使溶液中c(CH3COO-)为bmol/L,则此时c2(H+)=________________mol/L(用含a、b的代数式表示).
③c1(H+)__________ c2(H+)(填“大于”、“小于”或“等于”)
查看答案和解析>>
科目:高中化学 来源:2014届海南省琼海市高二下教学质量监测二化学卷(解析版) 题型:选择题
下列说法正确的是( )
A.pH=2和pH=1的硝酸中c(H+)之比为1:10
B.0.2 mol/L与0.1 mol/L醋酸中c(H+)之比为2:1
C.室温时,0.1mol/L 某一元酸HA在水中有0.1%发生电离,则该溶液的pH=4
D.25 ℃时,pH=13的1.0 L Ba(OH)2溶液中含有的OH- 数目为0.2NA
查看答案和解析>>
科目:高中化学 来源:2013届海南省高二上学期期末考试理科化学试卷(解析版) 题型:填空题
(10分)在一定温度下,醋酸溶液存在电离平衡:
CH3COOH  CH3COO- + H+
CH3COO- + H+
(1)某温度时,0.1mol/L的醋酸溶液中的c(H+) 与0.01mol/L c(H+)的比值 _________________(填“大于”、“小于”或“等于”)10
(2)已知:25℃时,该电离平衡的平衡常数为1.75×10-5
①求该温度时,amol/L的醋酸溶液中c1(H+)=________________mol/L (用含a的代数式表示)。[提示:此时a比较小,进行简化计算,平衡时c(CH3COOH)可用初始浓度代替,水电离出的c(H+) 、c(OH-)忽略不计,下同]
②若该温度时向该溶液中加入一定量的CH3COONH4(假设溶液体积不变),使溶液中c(CH3COO-)为bmol/L,则此时c2(H+)=________________mol/L(用含a、b的代数式表示).
③c1(H+)__________ c2(H+)(填“大于”、“小于”或“等于”)
[来源:]
查看答案和解析>>
科目:高中化学 来源:2012-2013学年湖北省部分重点中学高二(上)期中化学试卷(解析版) 题型:选择题
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com