
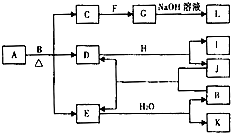
 ������Ԫ����ɵĻ�����A������ͼ��ʾ��ת����ϵ�����ֲ��P��Ӧ��������ȥ������֪��EΪ����ɫ���壬F��HΪ�������ʣ�JΪ��ɫ�ǽ������ʣ�L¶���ڿ�����ʱ���ɰ�ɫ����ת��Ϊ���ɫ��B��F��Ӧʱ������C��Ҳ������G���Իش��������⣺
������Ԫ����ɵĻ�����A������ͼ��ʾ��ת����ϵ�����ֲ��P��Ӧ��������ȥ������֪��EΪ����ɫ���壬F��HΪ�������ʣ�JΪ��ɫ�ǽ������ʣ�L¶���ڿ�����ʱ���ɰ�ɫ����ת��Ϊ���ɫ��B��F��Ӧʱ������C��Ҳ������G���Իش��������⣺���� EΪ����ɫ�����ж�ΪNO2��F��HΪ�������ʣ�L¶���ڿ�����ʱ���ɰ�ɫ����ת��Ϊ���ɫ���ƶ�LΪFe��OH��2��B��F��Ӧʱ������C��Ҳ������G��֤������FΪFe��BΪ���ᣬ����GΪFe��NO3��2��CΪFe��NO3��3��JΪ��̬�ǽ������ʺ�������ȷ�Ӧ���ɶ����������ж�DΪCO2��HΪ�������ʣ������ж�HΪMg��IΪMgO��E+H2O=B+K������֪�ǣ�3NO2+H2O=2HNO3+NO��KΪNO��A+B��HNO3��=G��Fe��NO3��2��+D��CO2��+E��NO2�����ж�A�к��е�Ԫ��Ϊ��Ԫ�غ�̼Ԫ�أ��Դ˽����⣮
��� �⣺EΪ����ɫ�����ж�ΪNO2��F��HΪ�������ʣ�L¶���ڿ�����ʱ���ɰ�ɫ����ת��Ϊ���ɫ���ƶ�LΪFe��OH��2��B��F��Ӧʱ������C��Ҳ������G��֤������FΪFe��BΪ���ᣬ����GΪFe��NO3��2��CΪFe��NO3��3��JΪ��̬�ǽ������ʺ�������ȷ�Ӧ���ɶ����������ж�DΪCO2��HΪ�������ʣ������ж�HΪMg��IΪMgO��E+H2O=B+K������֪�ǣ�3NO2+H2O=2HNO3+NO��KΪNO��A+B��HNO3��=G��Fe��NO3��2��+D��CO2��+E��NO2�����ж�A�к��е�Ԫ��Ϊ��Ԫ�غ�̼Ԫ�أ�
��1�������Ϸ�����֪KΪһ��������IΪMgO��Ϊ���Ӿ��壬�ʴ�Ϊ��һ�����������ӣ�
��2����Ԫ�غ�̼Ԫ�����ʵ���֮��$\frac{14}{56}$��$\frac{1}{12}$=3��1����ѧʽΪFe3C���ʴ�Ϊ��Fe3C��
��3��LΪFe��OH��2�����ȶ����ױ���������Fe ��OH ��3����Ӧ�Ļ�ѧ����ʽΪ4Fe ��OH ��2+O2+2H2O=4Fe ��OH ��3��
�ʴ�Ϊ��4Fe ��OH ��2+O2+2H2O=4Fe ��OH ��3��
��4��GΪFe��NO3��2�����л�ԭ�ԣ��ױ�������������Ӧ�����ӷ���ʽΪ3Fe2++4H++NO3-=3Fe3++NO��+2H2O��
�ʴ�Ϊ��3Fe2++4H++NO3-=3Fe3++NO��+2H2O��
��5����������Ӧ�������ǽ�����ȫ�ģ�������1mol LΪFe��OH��2��������Ԫ���غ�ͷ�ӦFe+2Fe3+=3Fe2+�������㣬��ҪAΪFe3C���ʵ���Ϊ��Ϊx��
Fe+2Fe3+=3Fe2+
2 3
3x 1mol
x=$\frac{2}{9}$mol=0.22mol��
�ʴ�Ϊ��0.22��
���� ���⿼��������ƶϣ�Ϊ��Ƶ���㣬��Ŀ�����������ʵ�ת����ϵ�ͷ�Ӧ��������Ӧ�����������ʵķ����жϣ���Ҫ�����ᡢ�����仯�������ʵķ���Ӧ�ã�������Ӧ�IJ���ͷ�Ӧ�����ǽ���ؼ�����Ŀ�Ѷ��еȣ�


 ���Ͱ�ͨ��ĩ���ϵ�д�
���Ͱ�ͨ��ĩ���ϵ�д�
| �꼶 | ���пγ� | �꼶 | ���пγ� |
| ��һ | ��һ��ѿγ��Ƽ��� | ��һ | ��һ��ѿγ��Ƽ��� |
| �߶� | �߶���ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
| ���� | ������ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
��Ŀ�����л�ѧ ��Դ�� ���ͣ������
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�ѡ����
| A�� | �۵㣺���飾2��2һ�������飾2��3һ�������飾���� | |
| B�� | �����������飾��ϩ����Ȳ���� | |
| C�� | �ܶȣ�CCl4��CHCl3������H2O | |
| D�� | ͬ���ʵ�������ȼ�պ�O2�������飾�����飾���������� |
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�ѡ����
| A�� | 0.2 mol•L-1 | B�� | 0.3 mol•L-1 | C�� | 0.02 mol•L-1 | D�� | 0.1 mol•L-1 |
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�ѡ����
| �缫��Ӧʽ | ���ֻ��� | |
| A | O2+2H2O+4e-�T4OH- | ���Ի���������ȼ�ϵ�صĸ�����Ӧ |
| B | 4OH--4e-�T2H2O+O2�� | �����Ի����¸�����������ʴ |
| C | 2H++2e-�TH2�� | �ö��Ե缫���NaOH��Һ��������Ӧ |
| D | H2-2e-�T2H+ | �ö��Ե缫���H2SO4��������Ӧ |
| A�� | A | B�� | B | C�� | C | D�� | D |
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ������
 ��
���鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�ѡ����
| A�� | H2O | B�� | NaCl | C�� | SO2 | D�� | HCl |
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�ѡ����
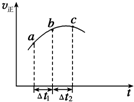 ����Ⱥ����ܱ�������ͨ��SO2��NO2һ��������ʹ��ӦSO2��g��+NO2��g��?SO3��g��+NO��g���ﵽƽ�⣬����Ӧ������ʱ��仯��ʾ��ͼ��ͼ��ʾ����ͼ�ɵó�����ȷ�����ǣ�������
����Ⱥ����ܱ�������ͨ��SO2��NO2һ��������ʹ��ӦSO2��g��+NO2��g��?SO3��g��+NO��g���ﵽƽ�⣬����Ӧ������ʱ��仯��ʾ��ͼ��ͼ��ʾ����ͼ�ɵó�����ȷ�����ǣ�������| A�� | ��t1=��t2ʱ��SO2��ת���ʣ�a��b��С��b��c�� | |
| B�� | ��Ӧ�������������������������� | |
| C�� | ��Ӧ��Ũ�ȣ�a��С��b�� | |
| D�� | ��Ӧ��C��ﵽƽ��״̬ |
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ������
�鿴�𰸺ͽ���>>
����ʡ������Υ���Ͳ�����Ϣ�ٱ�ƽ̨ | �����к���Ϣ�ٱ�ר�� | ����թƭ�ٱ�ר�� | ����ʷ���������к���Ϣ�ٱ�ר�� | ������Ȩ�ٱ�ר��
Υ���Ͳ�����Ϣ�ٱ��绰��027-86699610 �ٱ����䣺58377363@163.com