
(06年广东卷)钴(Co)化合物对化学键的研究起着重要的作用。为测定某钴化合物[Co(NH3)xCly]Clz的组成,进行如下实验:
①称取样品0.5010g,加入过量的NaOH溶液,煮沸,蒸出所有的氨,冷却,得到A。产生的氨用50.00mL0.5000mol?L-1的盐酸完全吸收并用蒸馏水定容至100mL,得溶液B。取B溶液20.00mL, 用0.1000mol?L-1NaOH滴定,消耗NaOH溶液30.00mL。
②向A中加入过量KI固体,振荡,盐酸酸化后置于暗处,发生反应:
Com++I-→Co2++I2 (未配平)
反应完成后,蒸馏水稀释,用Na2S2O3溶液滴定析出的I2,消耗0.1000mol?L-1Na2S2O3溶液20.00mL。反应方程式为:I2+2Na2S2O3==2NaI+Na2S4O6
③另称取该物质样品0.2505g,溶于水,以0.1000mol?L-1AgNO3溶液滴定至恰好反应完全,消耗AgNO3溶液20.00mL。相应反应式为:
[Co(NH3)xCly]Clz+zAgNO3==[Co(NH3)xCly](NO3)z+zAgCl↓
通过计算求:
⑴[Co(NH3)xCly]Clz中氮元素的质量分数。
⑵该钴化合物的化学式。
答案:
解:⑴NaOH+HCl=NaCl+H2O NH3+HCl=NH4Cl
20.00mLB溶液消耗0.1000mol?L-1NaOH 30.00mL。
20.00mLB溶液中过量的HCl:n(HCl)=0.003000mol ,
100mLB溶液中过量的HCl:n(HCl)=0.01500mol那么与NH3反应的n(HCl)=0.01000mol
故0.5010g样品中 n(NH3)=0.01000mol n(N)=0.01000mol
[Co(NH3)xCly]Clz中氮元素的质量分数
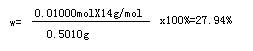
⑵ I2+2Na2S2O3==2NaI+Na2S4O6
因反应用去0.1000mol?L-1Na2S2O3溶液20.00mL,推算出:n(I2)=0.001000mol
Co与Fe同一族,Com+具有强氧化性,故设m=3
则有:2Co3++2I-==2Co2++I2 n(Co3+)=0.002000mol
0.5010g样品中Cl的总质量为:
m(Cl)=0.5010g-0.002000molx59g?mol -1-0.01000molx17g ?mol -1=0.2130g
n(Cl)=0.006000mol
又有:[Co(NH3)xCly]Clz+zAgNO3==[Co(NH3)xCly](NO3)z+zAgCl↓
0.2505g样品扩大一倍来算(即用0.5010g)推算出:
反应消耗AgNO3:n(AgNO3)=0.1000mol?L-1x40.00mL=0.004000mol
即发生上述反应的Cl-为:n(Cl-) =0.004000mol
则有 y:z=(0.006000mol-0.004000 mol): 0.004000mol=1:2
同时还有:1:x:(y+z)= 0.002000: 0.01000: 0.006000=1:5:3
解得:x=5 y=1 z=2
带入[Co(NH3)xCly]Clz中,求得Co化合价为:+3 假设成立
该钴化合物的化学式为:[Co(NH3)5Cl]Cl2
答:⑴[Co(NH3)xCly]Clz中氮元素的质量分数为27.94%
⑵该钴化合物的化学式为:[Co(NH3)5Cl]Cl2


湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com