
(16分)氯碱工业是最基本的化学工业之一,它的产品除应用于化学工业本身外,还广泛应用于轻工业、纺织工业、冶金工业、石油化学工业以及公用事业。
⑴以前采用无隔膜电解冷的食盐水时,Cl2会与NaOH接触,产物中肯定有NaClO,从而影响产品的纯度。能包含这一过程的总反应方程式为
⑵现代氯碱工业多采用隔膜法进行电解,即用隔膜将电解槽分隔成阳极区和阴极区,则从阴极区排出的是 ,电解时用盐酸控制阳极区的PH在2~3,用化学平衡移动原理解释盐酸的作用:
(3)氯碱工业是高耗能产业,一种将电解池与燃料电池相组合的新工艺可以节(电)能30%以上。在这种工艺设计中,相关物料的传输与转化关系如下图所示,其中的电极未标出,所用的离子膜都只允许阳离子通过。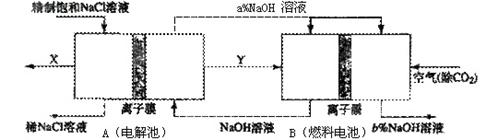 ①分析比较图中氢氧化鈉质量分数大小:a% (填“>”、“<”或“=”) b%, 理由是
①分析比较图中氢氧化鈉质量分数大小:a% (填“>”、“<”或“=”) b%, 理由是
②这样设计的主要节(电))能之处在于 (至少写一处)
⑷科研人员为减少火力发电厂对环境的污染,曾经考虑让火力发电厂和氯碱厂进行就近联合。请你判断该方案是否可行? (填可行或不可行),理由是
(1)NaCl+H2O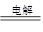 NaClO+H2↑
NaClO+H2↑
(2)H2和NaOH; Cl2与水反应:Cl2+ H2O= HClO+HCl,增大HCl的浓度使平衡逆向移动,减少Cl2在水中的溶解,有利于Cl2逸出
(3)①<;在B中右侧为燃料电池正极,氧气被还原产生OH-,同时Na+通过离子膜移到该侧,所以NaOH溶液浓度增大
②燃料电池可以补充电解池消耗的电能(或燃料电池提高了产出碱液的浓度,降低能耗等其他合理答案均可)
(4)可行;将发电厂产生的废气(SO2)与氯碱厂产生的Cl2或NaOH反应,既减少了SO2的排放,又可产生多种化学原料,同时就近联合还能减少电力输送中的损耗(其他合理答案均可)
解析


科目:高中化学 来源: 题型:
(16分) 下图中甲、乙、丙的电极材料都是石墨和铁,其中丙是氯碱工业生产示意图。
(1)若甲、乙两烧杯均盛放CuSO4溶液,
①甲中铁棒上的电极反应式为_______________________________________。
②乙装置工作一段时间后,向烧杯中加入适量的碱式碳酸铜【Cu2(OH)2CO3】,能使溶液恢复到起始状态,请写出这段时间内乙装置发生的所有反应的化学方程式
________________________________________________________________________。
(2)若甲、乙两烧杯均盛放饱和NaCl溶液,
①甲中石墨棒上的电极反应式为___________________。
②将湿润的淀粉碘化钾试纸放在乙烧杯______(填“Fe”或“C”)电极的上方,发现试纸先变蓝后褪色,这是因为过量的Cl2氧化了生成的I2。若反应物Cl2和I2的物质的量之比为5∶1,且生成两种酸,则其对应的化学方程式为_________________________。
③假设产生的气体全部逸出溶液,当乙反应有0.01 mol电子转移后停止实验,此时烧杯中溶液的体积为100 mL,则溶液混合均匀后的pH = ____________。
④当乙中的反应用于工业生产时,为了阻止两极产物之间的反应,通常使用如丙图所示的装置,其中离子交换膜只允许Na+通过,Na+的移动方向如图中标注,则H2的出口是________(填代号)。
查看答案和解析>>
科目:高中化学 来源:2010年重庆市西南师大附中高三上学期第一次月考(理综)化学部分 题型:填空题
(16分) 下图中甲、乙、丙的电极材料都是石墨和铁,其中丙是氯碱工业生产示意图。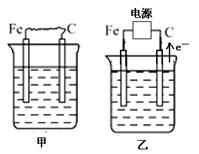

(1)若甲、乙两烧杯均盛放CuSO4溶液,
①甲中铁棒上的电极反应式为_______________________________________。
②乙装置工作一段时间后,向烧杯中加入适量的碱式碳酸铜【Cu2(OH)2CO3】,能使溶液恢复到起始状态,请写出这段时间内乙装置发生的所有反应的化学方程式
________________________________________________________________________。
(2)若甲、乙两烧杯均盛放饱和NaCl溶液,
①甲中石墨棒上的电极反应式为___________________。
②将湿润的淀粉碘化钾试纸放在乙烧杯______(填“Fe”或“C”)电极的上方,发现试纸先变蓝后褪色,这是因为过量的Cl2氧化了生成的I2。若反应物Cl2和I2的物质的量之比为5∶1,且生成两种酸,则其对应的化学方程式为_________________________。
③假设产生的气体全部逸出溶液,当乙反应有0.01 mol电子转移后停止实验,此时烧杯中溶液的体积为100 mL,则溶液混合均匀后的pH = ____________。
④当乙中的反应用于工业生产时,为了阻止两极产物之间的反应,通常使用如丙图所示的装置,其中离子交换膜只允许Na+通过,Na+的移动方向如图中标注,则H2的出口是________(填代号)。
查看答案和解析>>
科目:高中化学 来源:2013届河南周口重点高中四校高二下学期第一次联考化学卷(解析版) 题型:填空题
(16分)氯碱工业是最基本的化学工业之一,它的产品除应用于化学工业本身外,还广泛应用于轻工业、纺织工业、冶金工业、石油化学工业以及公用事业。
⑴以前采用无隔膜电解冷的食盐水时,Cl2会与NaOH接触,产物中肯定有NaClO,从而影响产品的纯度。能包含这一过程的总反应方程式为
⑵现代氯碱工业多采用隔膜法进行电解,即用隔膜将电解槽分隔成阳极区和阴极区,则从阴极区排出的是 ,电解时用盐酸控制阳极区的PH在2~3,用化学平衡移动原理解释盐酸的作用:
(3) 氯碱工业是高耗能产业,一种将电解池与燃料电池相组合的新工艺可以节(电)能30%以上。在这种工艺设计中,相关物料的传输与转化关系如下图所示,其中的电极未标出,所用的离子膜都只允许阳离子通过。
 ①分析比较图中氢氧化鈉质量分数大小:a%
(填“>”、“<”或“=”) b%, 理由是
①分析比较图中氢氧化鈉质量分数大小:a%
(填“>”、“<”或“=”) b%, 理由是
②这样设计的主要节(电))能之处在于 (至少写一处)
⑷ 科研人员为减少火力发电厂对环境的污染,曾经考虑让火力发电厂和氯碱厂进行就近联合。请你判断该方案是否可行? (填可行或不可行),理由是
查看答案和解析>>
科目:高中化学 来源:2010年重庆市高三上学期第一次月考(理综)化学部分 题型:填空题
(16分) 下图中甲、乙、丙的电极材料都是石墨和铁,其中丙是氯碱工业生产示意图。
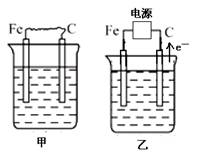
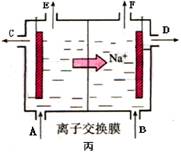
(1)若甲、乙两烧杯均盛放CuSO4溶液,
①甲中铁棒上的电极反应式为_______________________________________。
②乙装置工作一段时间后,向烧杯中加入适量的碱式碳酸铜【Cu2(OH)2CO3】,能使溶液恢复到起始状态,请写出这段时间内乙装置发生的所有反应的化学方程式
________________________________________________________________________。
(2)若甲、乙两烧杯均盛放饱和NaCl溶液,
①甲中石墨棒上的电极反应式为___________________。
②将湿润的淀粉碘化钾试纸放在乙烧杯______(填“Fe”或“C”)电极的上方,发现试纸先变蓝后褪色,这是因为过量的Cl2氧化了生成的I2。若反应物Cl2和I2的物质的量之比为5∶1,且生成两种酸,则其对应的化学方程式为_________________________。
③假设产生的气体全部逸出溶液,当乙反应有0.01 mol电子转移后停止实验,此时烧杯中溶液的体积为100 mL,则溶液混合均匀后的pH = ____________。
④当乙中的反应用于工业生产时,为了阻止两极产物之间的反应,通常使用如丙图所示的装置,其中离子交换膜只允许Na+通过,Na+的移动方向如图中标注,则H2的出口是________(填代号)。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com