
 名校课堂系列答案
名校课堂系列答案科目:高中化学 来源: 题型:
查看答案和解析>>
科目:高中化学 来源: 题型:阅读理解

查看答案和解析>>
科目:高中化学 来源: 题型:阅读理解
【方法一】在氧充足条件下,通过好氧硝化菌的作用,将废水中氨态氮转化为中间过渡形态的硝酸态氮和亚硝酸态氮,然后在缺氧条件下,利用反硝化菌,硝酸态氮和亚硝酸态氮被水中的有机物还原为氮气。见图中之①。反应过程为如下(注:有机物以甲醇表示;当废水中有机物不足时,需另外投加有机碳源)。
2![]() +3O2
+3O2![]() 2HNO2+2H2O+2H+
2HNO2+2H2O+2H+
2HNO2+O2![]() 2HNO3
2HNO3
6![]() +2CH3OH
+2CH3OH![]() 6
6![]() +2CO2+4H2O
+2CO2+4H2O
6![]() +3CH3OH
+3CH3OH![]() 3N2+3CO2+3H2O+6OH-
3N2+3CO2+3H2O+6OH-
【方法二】与方法一相比,差异仅为硝化过程的中间过渡形态只有亚硝酸态氮。见图中之②。

请回答以下问题:
(1)![]() 的空间构型为__________。大气中的氮氧化物的危害有________和________等。
的空间构型为__________。大气中的氮氧化物的危害有________和________等。
(2)方法一中氨态氮元素
(3)从原料消耗的角度说明方法二比方法一有优势的原因:_________________________。
(4)自然界中也存在反硝化作用,使硝酸盐还原成氮气,从而降低了土壤中氮素营养的含量,对农业生产不利,农业上可通过松土作业,以防止反硝化作用。其原因是______________。
(5)荷兰Delft大学Kluyver生物技术实验室试验确认了一种新途径。在厌氧条件下,以亚硝酸盐作为氧化剂,在自养菌作用下将氨态氮(氨态氮以![]() 表示)氧化为氮气(见图中过程③)。其反应离子方程式为___________________________________________________。
表示)氧化为氮气(见图中过程③)。其反应离子方程式为___________________________________________________。
查看答案和解析>>
科目:高中化学 来源: 题型:阅读理解
废水中的氮常以含氮有机物、氨、硝酸盐及亚硝酸盐等形式存在。生物处理的方法是先将大多数有机态氮转化为氨态氮,然后通过进一步转化成N2而消除污染。生物除氮工艺有以下几种方法:
【方法一】在好氧条件下,通过好氧硝化菌的作用,将废水中氨态氮转化为中间过渡形态的硝酸态氮和亚硝酸态氮,然后在缺氧条件下,利用反硝化菌,硝酸态氮和亚硝酸态氮被水中的有机物还原为氮气。见图中之①。反应过程为如下(注:有机物以甲醇表示;当废水中有机物不足时,需另外投加有机碳源)。2NH4++3O2==2HNO2 +2H2O +2H+ 2HNO2 +O2===2HNO3
6NO3―+2CH3OH→6NO2―+2CO2+ 4H2O 6NO2―+3CH3OH→3N2 +3CO2+ 3H2O+ 6OH―
【方法二】与方法一相比,差异仅为硝化过程的中间过渡形态只有亚硝酸态氮。见图中之②。
 |
请回答以下问题:
(1)NH4+的空间构型为 。大气中的氮氧化物的危害有 和 等。
(2)方法一中氨态氮元素1g转化为硝酸态氮时需氧的质量为 g。
(3)从原料消耗的角度说明方法二比方法一有优势的原因: 。
(4)自然界中也存在反硝化作用,使硝酸盐还原成氮气,从而降低了土壤中氮素营养的含量,对农业生产不利,农业上可通过松土作业,以防止反硝化作用。其原因是 。
(5)荷兰Delft大学Kluyver生物技术实验室试验确认了一种新途径。在厌氧条件下,以亚硝酸盐作为氧化剂,在自养菌作用下将氨态氮(氨态氮以NH4+表示)氧化为氮气(见图中过程③)。其反应离子方程式为 。
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
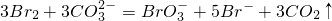 ;③
;③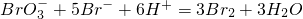 .其中③中发生还原反应的离子是______.
.其中③中发生还原反应的离子是______.查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com