
A.12 B.7 C.6 D.10
科目:高中化学 来源: 题型:
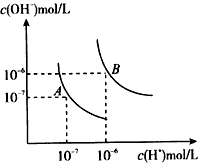
 水的电离平衡曲线如图所示,若以A点表示25℃时水的电离达平衡时的离子浓度,B点表示100℃时水的电离达平衡时的离子浓度,则下列说法正确的是( )
水的电离平衡曲线如图所示,若以A点表示25℃时水的电离达平衡时的离子浓度,B点表示100℃时水的电离达平衡时的离子浓度,则下列说法正确的是( )| A、纯水中25°C时的,c(H+)比100℃的时c(H+)大 | B、100℃时某溶液中由水电离产生的c(H+)═1×10-11mol?L-1,则该溶液的Ph可能是11或3 | C、将pH=9的Ba(OH)2溶液与pH=4的稀盐酸混合,并保持100℃的恒温,混合溶液的pH=7,则Ba(OH)2溶液和盐酸的体积比为10:1 | D、25℃时,某Na2SO4溶液中c(SO 42-)=5.0×10-4mol/L则溶液中c(Na+):c(OH-)为104:1 |
查看答案和解析>>
科目:高中化学 来源:2015届山东省临沂市高二上学期期中考试化学试卷(解析版) 题型:选择题
水的电离平衡曲线如图所示, 若以A点表示25℃时水的电离达平衡时的离子浓度,B点表示100℃时水的电离达平衡时的离子浓度,则下列说法正确的是

A.纯水中25℃时的c(H+)比100℃时的c(H+)大
B.100℃时某溶液中由水电离产生的c(H+)=1×10-11mol/L,则该溶液的pH可能是11或3
C.将pH=9的Ba(OH)2溶液与pH=4的稀盐酸混合,并保持100℃的恒温,混合溶液的pH=7,则Ba(OH)2溶液和盐酸的体积比为10: 1
D.25℃时,某Na2SO4 溶液中c(SO42-)=5×10-4 mol/L,则溶液中c(Na+):c(OH-)为104:1
查看答案和解析>>
科目:高中化学 来源:辽宁省期末题 题型:单选题
查看答案和解析>>
科目:高中化学 来源: 题型:
水的电离平衡曲线如图所示,若以A点表示25°C时水的电离达平衡时的离子浓度,B点表示1000C 时水的电离达平衡时的离子浓度,
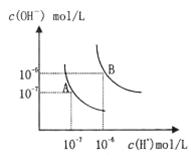
则下列说法正确的是 ( )
A.纯水中25°C时的,c(H+)比100℃ 的时c(H+)大
B.1000C时某溶液中由水电离产生的c(H+)=1×10-11mol·L-1,则该溶液的pH可能是11或3
C.将pH=9的Ba(OH)2溶液与pH=4的稀盐酸混合,并保持1000C的恒温,混合溶液的pH=7,则Ba(OH)2溶液和盐酸的体积比为10: 1
D.25℃时,某NaSO2SO4溶液中c(SO22-4)=5×10-4mol/L,则溶液中c(Na+):c(OH-)为104:1
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com