
【题目】在100℃时,把0.5mol N2O4通入体积为5L的真空密闭容器中,立即出现红棕色.反应进行到2s时,NO2的浓度为0.02molL﹣1 . 在60s时,体系已达平衡,此时容器内压强为开始时的1.6倍.请回答下列问题:
(1)前2s以N2O4的浓度变化表示的平均反应速率为;
(2)平衡时,NO2的体积分数为;
(3)平衡时,N2O4的转化率为;
(4)平衡时,混合气体的平均摩尔质量为 .
【答案】
(1)0.005mol?L﹣1s﹣1
(2)75%
(3)60%
(4)57.5g?mol﹣1
【解析】解:2秒时,NO2的浓度为0.02摩/升,则转化的N2O4的浓度为0.01mol/L,则前2秒,以N2O4的浓度变化表示的平均反应速度;
依据化学平衡三段式列式计算,反应进行到60s时,体系已达平衡,此时容器内压强为开始时的1.6倍,设消耗N2O4的物质的量为x,列式计算
N2O4 | ═ | 2NO2 | |
起始量(mol) | 0.5 | 0 | |
变化量(mol) | x | 2x | |
平衡量(mol) | 0.5﹣x | 2x |
0.5﹣x+2x=0.5×1.6
x=0.3mol
(1.)2秒时,NO2的浓度为0.02摩/升,则转化的N2O4的浓度为0.01mol/L,则前2秒,以N2O4的浓度变化表示的平均反应速度为 ![]() =0.005mol/L.s;所以答案是:0.005mol/L.s;
=0.005mol/L.s;所以答案是:0.005mol/L.s;
(2.)平衡时,NO2的体积分数= ![]() ×100%=
×100%= ![]() ×100%=75%;所以答案是:75%;
×100%=75%;所以答案是:75%;
(3.)平衡时,N2O4的转化率= ![]() ×100%=60%;所以答案是:60%;
×100%=60%;所以答案是:60%;
(4.)平衡时,混合气体的平均摩尔质量= ![]() =
= ![]() =57.5g/mol;
=57.5g/mol;
所以答案是:57.5gmol﹣1;
【考点精析】解答此题的关键在于理解化学平衡的计算的相关知识,掌握反应物转化率=转化浓度÷起始浓度×100%=转化物质的量÷起始物质的量×100%;产品的产率=实际生成产物的物质的量÷理论上可得到产物的物质的量×100%.


科目:高中化学 来源: 题型:
【题目】可逆反应:3A(g)![]() 3B(?)+C(?)△H>0,随着温度升高,气体平均相对分子质量有变小趋势,则下列判断正确的是( )
3B(?)+C(?)△H>0,随着温度升高,气体平均相对分子质量有变小趋势,则下列判断正确的是( )
A. B和C可能都是固体 B. 若C为固体,则B一定是气体
C. B和C一定都是气体 D. B和C不可能都是气体
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】已知3.01×1023个X2气体分子的质量为16g,则X的相对原子质量是( )
A. 16 B. 32 C. 64g /mol D. 32g /mol
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】关于下列装置说法正确的是( )
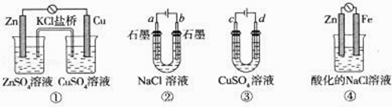
A. 装置①中,盐桥中的K+移向ZnSO4溶液
B. 滴有酚酞溶液的装置②在电解过程中,b极先变红
C. 可以用装置③在铁上镀铜,d极为铜
D. 装置④中发生铁的吸氧腐蚀
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列各式中属于正确的水解反应离子方程式的是( )
A.NH4++H2ONH3·H2O+H+B.S2-+2H2OH2S+2OH-
C.CH3COOH+H2OCH3COO-+H3O+D.CH3COOH+OH-CH3COO-+H2O
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】A,B,C均为短周期元素,它们在周期表中的位置如图所示.已知:B,C两元素原子最外层电子数之和等于A元素原子最外层电子数的2倍;B,C两元素的核电荷数之和是A元素原子序数的4倍.则A,B,C分别是( ) 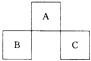
A.C,Al,P
B.N,Si,S
C.0,P,Cl
D.F,S,Ar
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】向含 S2-、 Fe2+、 Br -、 I-各 0.1 mol 的溶液中通入 Cl2, 通入 Cl2 的体积(标准状况) 和溶液中相关离子的物质的量的关系图正确的是

A. A B. B C. C D. D
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列与有机物的结构、性质的有关叙述中正确的是( )
A.乙酸与乙醇可以发生酯化反应,又均可与金属钠发生反应
B.乙烯、聚乙烯均可使酸性高锰酸钾溶液褪色
C.分馏、干馏都是物理变化,裂化、裂解都是化学变化
D.石油经过分馏得到多种烃,煤经过分馏可制得焦炭、煤焦油等产品
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com