
分析 (1)已知:①.OHC-CHO(g)+2H2(g)?HOCH2CH2OH(g)△H=-78kJ•mol-1 K1
②.2H2(g)+O2(g)?2H2O(g)△H=-484kJ•mol-1 K2
根据盖斯定律,②-①可得:HOCH2CH2OH(g)+O2(g)?OHC-CHO(g)+2H2O(g),反应热也进行相应计算,
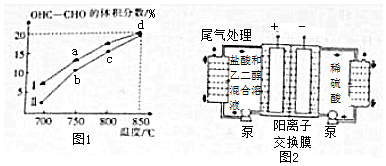
(2)①由图象得,升高温度OHC-CHO的体积分数增加,故向正反应方向进行,即v正 大于v逆;d点达到平衡,故v正=v逆,据此进行分析;
②w=$\frac{{n}_{变}}{{n}_{原}}×100%$,据此进行计算;K=$\frac{{c}^{2}({H}_{2}O)c(OHC-CHO)}{c(HOC{H}_{2}C{H}_{2}OH)c({O}_{2})}$进行计算;
(3)增强溶液导电性.
解答 解:(1)已知:①.OHC-CHO(g)+2H2(g)?HOCH2CH2OH(g)△H=-78kJ•mol-1 K1
②.2H2(g)+O2(g)?2H2O(g)△H=-484kJ•mol-1 K2
根据盖斯定律,②-①可得:HOCH2CH2OH(g)+O2(g)?OHC-CHO(g)+2H2O(g),则△H=-484kJ•mol-1-(-78kJ•mol-1)=-406kJ•mol-1,
故答案为:-406;
(2)①由图象得,升高温度OHC-CHO的体积分数增加,故向正反应方向进行,即v正 大于v逆;d点达到平衡,故v正=v逆,
故答案为:大于;d;
②HOCH2CH2OH(g)+O2(g)?OHC-CHO(g)+2H2O(g)
开始(c) 2 2 0 0
变化 0.6 0.6 0.6 1.2
平衡 1.4 1.4 4×15%=0.6 1.2,w( HOCH2CH2OH)=$\frac{{n}_{变}}{{n}_{原}}×100%$=$\frac{0.6}{2}×100%$=30%;K=$\frac{{c}^{2}({H}_{2}O)c(OHC-CHO)}{c(HOC{H}_{2}C{H}_{2}OH)c({O}_{2})}$=$\frac{1.{2}^{2}×0.6}{1.4×1.4}$=0.44,
故答案为:30%;0.44;
(3)阳极液中盐酸可以增强溶液导电性,
故答案为:增强溶液导电性.
点评 本题考查反应热的计算,化学平衡的移动,转化率,平衡常数的计算等,本题难度中等.


科目:高中化学 来源: 题型:填空题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
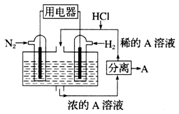 科学家设想,N2和H2为反应物,以溶有A的稀盐酸为电解质溶液,可制造出既能提供电能又能固氮的新型燃料电池,装置如图所示.下列说法不正确的是( )
科学家设想,N2和H2为反应物,以溶有A的稀盐酸为电解质溶液,可制造出既能提供电能又能固氮的新型燃料电池,装置如图所示.下列说法不正确的是( )| A. | A为NH4Cl | |
| B. | 反应过程中溶液的pH会变大,故需要加入盐酸 | |
| C. | 该电池外电路电子从通入N2的电极流向通入H2的电极 | |
| D. | 通入N2的电极发生的电极反应式为N2+6e-+8H+=2NH+ |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 标准状况下,11.2LCCl4中含有的分子数为0.5NA | |
| B. | 在Na2O2与水的反应中,每生成1molO2,转移电子数目为2NA | |
| C. | 常温常压下,等物质的量浓度的Na2CO3与Na2S溶液Na+数目相等 | |
| D. | 常温常压下,4.6g乙醇中含有极性共价键的数目为0.8NA |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 用葡萄糖制镜或保温瓶胆 | |
| B. | 用漂白液杀菌、消毒 | |
| C. | 用Na2SiO3溶液制备木材防火剂 | |
| D. | 用浸泡过高锰酸钾的硅藻土保鲜水果 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
 CO2经催化加氢可合成乙烯:2CO2 (g)+6H2(g)?C2H4(g)+4H2O(g).0.1MPa时,按n(CO2):n(H2)=l:3投料,测得不同温度下平衡时体系中各物质浓度的关系如图.下列叙述不正确的是( )
CO2经催化加氢可合成乙烯:2CO2 (g)+6H2(g)?C2H4(g)+4H2O(g).0.1MPa时,按n(CO2):n(H2)=l:3投料,测得不同温度下平衡时体系中各物质浓度的关系如图.下列叙述不正确的是( )| A. | 该反应的△H<O | |
| B. | 曲线b代表H2O | |
| C. | N点和M点所处状态的c(H2)不一样 | |
| D. | 其它条件不变,T1℃、0.2 MPa下反应达平衡时c(H2)比M点大 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 常温下都不能用铝制容器贮存 | |
| B. | 滴在紫色石蕊试纸上,试纸都变黑 | |
| C. | 常温下都能与铜较快反应 | |
| D. | 露置在空气中,容器内酸液的浓度都降低 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 1 mol ICl溶于NaOH溶液中生成NaC1和NaIO时,转移的电子数为NA | |
| B. | 常温下,1 L PH=2的HC1溶液和1 L PH=1的CH3COOH溶液混合后,混合溶液中所含的氢离子数目大于0.11NA | |
| C. | 常温下,含有NA个NO2和N2O4分子的混合气体,温度降至标准状况,其体积约为22.4 L | |
| D. | 常里常压下,18g D2O中所含中子数为10NA |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com