


科目:高中化学 来源: 题型:
| A、5.6g铁在足量氯气中燃烧,电子转移数为0.2 NA |
| B、标准状况下,22.4LCCl4中含有的原子数为5NA |
| C、常温常压下,7.8gNa2O2与足量的CO2反应时电子转移数为0.1NA |
| D、在常温常压下,22.4L氯水中含有的Cl2、HClO、Cl-和ClO-的总数为NA |
查看答案和解析>>
科目:高中化学 来源: 题型:

| A、铜作正极,发生氧化反应 |
| B、外电路中电子的移动方向为Fe→Cu |
| C、Fe电极的电极反应式为Fe-3e-═Fe3+ |
| D、盐桥中Cl-向正极移动 |
查看答案和解析>>
科目:高中化学 来源: 题型:

查看答案和解析>>
科目:高中化学 来源: 题型:

查看答案和解析>>
科目:高中化学 来源: 题型:
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、铜片跟稀硝酸反应:Cu+4H++NO3-═Cu2++NO↑+2H2O |
| B、AlCl3溶液中加入过量氨水:Al3++4OH-═AlO2-+2H2O |
| C、FeBr2溶液与等物质的量Cl2反应:2Fe2++2Br-+2Cl2═2Fe3++4Cl-+Br2 |
| D、向小苏打溶液中加入过量的石灰水:Ca2++2OH-+2HCO3-═CaCO3↓+CO32-+2H2O |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、达到化学平衡时,4v正(O2)=5v逆(NO) |
| B、若单位时间内生成x mol NO,同时消耗x mol NH3,则反应达到平衡状态 |
| C、达到化学平衡时,若缩小容器体积,则正反应速率减少,逆反应速率增大 |
| D、在恒容容器中,若混合气体密度不再改变,则反应达到平衡状态 |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、中子数为14的硅原子:1428Si |
B、CH4分子的比例模型 |
C、聚乙烯的结构简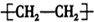 |
| D、次氯酸分子的结构式:H-O-Cl |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com