
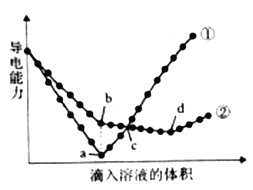
【题目】在两份相同的Ba(OH)2溶液中,分别滴入物质的量浓度相等的H2SO4、NaHSO4溶液。其导电能力随滴入溶液体积变化的曲线如下图所示。请回答下列问题。
(1)写出NaHSO4溶液中,NaHSO4的电离方程式________。
(2)图中①、②分别代表滴加哪种溶液的变化曲线①_______、②______。
(3)b点,溶液中大量存在的离子是______ 。
(4)a、d两点对应的溶液均显______ (填“酸性“中性”或“碱性”)。
(5)曲线②中d点导电能力最弱的原因是______ (用化学方程式表示)。
(6)c点,两溶液中含有相同量的哪种离子______。
【答案】 NaHSO4=Na++H++SO42- H2SO4 NaHSO4 Na+、OH– 中性 Ba(OH)2+2NaHSO4=BaSO4↓+Na2SO4+2H2O SO42–
【解析】试题分析:本题考查电离方程式的书写和符合条件的化学方程式的书写,溶液导电性的分析,图像分析。
(1)NaHSO4属于强酸的酸式盐,在水溶液中的电离方程式为:NaHSO4=Na++H++SO42-。
(2)Ba(OH)2溶液中导电离子为Ba2+、OH-。若向Ba(OH)2溶液中滴加H2SO4溶液,发生离子反应:Ba2++2OH-+2H++SO42-=BaSO4↓+2H2O,BaSO4难溶于水,H2O难电离,溶液中离子浓度减小,溶液导电能力减弱;当两者恰好完全反应时,溶液中离子浓度接近0,导电能力接近0;继续加H2SO4,溶液中离子浓度又增大,导电能力又增强,曲线①表示此过程,曲线①代表加入H2SO4溶液。若向Ba(OH)2溶液中滴加NaHSO4溶液,开始Ba(OH)2过量,发生的反应为:Ba(OH)2+NaHSO4=BaSO4↓+NaOH+H2O,BaSO4难溶于水,H2O难电离,溶液中离子浓度减小,溶液导电能力减弱;当Ba2+恰好完全沉淀时,溶液中溶质为NaOH,此时Na+、OH-导电;继续加入NaHSO4,发生反应NaOH+NaHSO4=Na2SO4+H2O,NaOH完全消耗时导电能力最小;继续加入NaHSO4溶液,溶液中离子浓度增大,导电能力又增强;曲线②表示此过程,曲线②表示表示加入NaHSO4溶液。
(3)根据上述分析,b点表示向Ba(OH)2溶液中加入NaHSO4溶液至Ba2+恰好完全沉淀,反应的化学方程式为:Ba(OH)2+NaHSO4=BaSO4↓+NaOH+H2O,此时溶液中大量存在的离子是Na+、OH-。
(4)a点表示Ba(OH)2溶液与H2SO4溶液恰好完全反应,反应的化学方程式为:Ba(OH)2+H2SO4=BaSO4↓+2H2O,此时溶液呈中性。d点表示Ba(OH)2溶液中加入NaHSO4溶液OH-完全中和,反应的化学方程式为:Ba(OH)2+2NaHSO4=BaSO4↓+2H2O+Na2SO4,此时溶液呈中性。a、d点对应的溶液均呈中性。
(5)曲线②中d点溶液中离子浓度最小,导电能力最弱,反应的化学方程式为:Ba(OH)2+2NaHSO4=BaSO4↓+2H2O+Na2SO4。
(6)a、b点表示加入的溶液将Ba2+完全沉淀;c点加入的溶液的体积大于a、b点,c点表示向两份相同的Ba(OH)2溶液中加入物质的量浓度相等的等体积的H2SO4和NaHSO4溶液,等体积等浓度的H2SO4和NaHSO4溶液SO42-相等、H+不相等,Ba2+消耗的SO42-相同,则两溶液中剩余的SO42-的量相同。


 培优口算题卡系列答案
培优口算题卡系列答案 开心口算题卡系列答案
开心口算题卡系列答案 口算题卡河北少年儿童出版社系列答案
口算题卡河北少年儿童出版社系列答案科目:高中化学 来源: 题型:
【题目】S2C12是广泛用于橡胶工业的硫化剂,常温下,S2C12是一种橙黄色的液体,遇水易水解,并产生 能使品红褪色的气体。S2Cl2的结构与H2O2类似。下列说法不正确的是( )

A. S2C12分子中的两个S原子均是sp3杂化
B. S2C12 与 H2O 反应的化学方程式是:2S2C12 +2H2O=SO2↑+3S↓+4HC1
C. S2Br2 与 S2C12 结构相似,熔、沸点:S2Br2 >S2C12
D. S2C12是含有极性键和非极性键的非极性分子
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】标准状况下VL氨气溶解在1L水中(水的密度近似为1g/mL),所得溶液的密度为ρg/mL,质量分数为ω,物质的量浓度为cmol/L,则下列关系中不正确的是( )
A. ![]() B.
B. ![]() C.
C. ![]() D.
D. ![]()
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】化学式C8H10O的化合物A具有如下性质;①A+Na![]() 慢慢产生气泡 ②A+RCOOH
慢慢产生气泡 ②A+RCOOH![]() 有香味的产物 ③A
有香味的产物 ③A![]() 苯甲酸 ④其催化脱氢产物不能发生银镜反应 ⑤脱水反应的产物,经聚合反应可制得一种塑料制品(它是目前造成“白色污染”的主要污染源之一)。
苯甲酸 ④其催化脱氢产物不能发生银镜反应 ⑤脱水反应的产物,经聚合反应可制得一种塑料制品(它是目前造成“白色污染”的主要污染源之一)。
试回答;
(1)根据上述信息,对该化合物的结构可作出的判断是_____________;
A.苯环上直接连有羟基 B.苯环侧链末端有甲基
C.肯定有醇羟基 D.肯定是芳香烃
(2)化合物A的结构简式_____________;
(3)A和金属钠反应的化学方程式_______________________________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某温度时,BaSO4在水中的沉淀溶解平衡曲线如图所示。已知:p(Ba2+) = -lgc(Ba2+ ),p(SO42-)=-lgc(SO42-).下列说法正确的是( )

A. 该温度下,Ksp( BaS04) =1.0xl0-24
B. a 点的 Ksp(BaS04)小于 b 点的 Ksp(BaSO4)
C. d点表示的是该温度下BaS04的不饱和溶液
D. 加入BaCl2可以使溶液由c点变到a点
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】镁和铝分别与等浓度、等体积的过量稀硫酸反应,产生气体的体积(V)与时间(t)关系如图。反应中镁和铝的 ( )
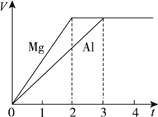
A. 摩尔质量之比为2∶3
B. 物质质量之比为3∶2
C. 物质的量之比为3∶2
D. 物质的量之比为2∶3
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】用下图实验装置制取乙酸乙酯。回答以下问题;

(1)在A试管中加入乙醇、乙酸和浓硫酸的顺序是_______________________________。
(2)写出A试管中发生反应的化学方程式___________________________________________
(3)B试管中所装液体应为___________,乙酸乙酯生成后,将在该溶液的______(填“上”或“下”)层,分离出该产品所需的主要仪器是_________________________________________
(4)该装置用球形干燥管代替长导管,并将干燥管的末端插入B中液面以下,在此处球形干燥管的作用有①_________________________________________________________
②_________________________________________________________________________
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】工业上曾经通过反应“3Fe + 4NaOH![]() Fe3O4+ 2H2↑+4Na↑” 生产金属钠。下列有关说法正确的是
Fe3O4+ 2H2↑+4Na↑” 生产金属钠。下列有关说法正确的是
A. 用磁铁可以将Fe与Fe3O4分离 B. 将生成的气体在空气中冷却可获得钠
C. 该反应条件下铁的氧化性比钠强 D. 每生成lmolH2,转移的电子数约为4×6.02×1023
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】现有某铁碳合金(铁和碳两种单质的混合物),某化学兴趣小组为了测定铁碳合金中铁的质量分数,并探究浓硫酸的某些性质,设计了下图所示的实验装置(夹持仪器已省略)和实验方案进行实验探究。
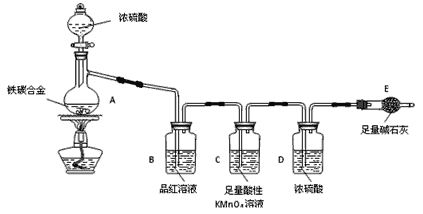
I.测定铁的质量分数:
(1)检查上述装置气密性的一种方法是:关闭分液漏斗的活塞,在E装置后面连上一根导管,然后___________________________________________________________________,则证明装置的气密性良好。
(2)称量E的质量,并将a g铁碳合金样品放入装置A中,再加入足量的浓硫酸,待A中不再逸出气体时,停止加热,拆下E并称重,E增重b g。铁碳合金中铁的质量分数为______________________(写表达式)。
(3)装置C的作用______________________________________________。s5
(4)甲同学认为,依据此实验测得的数据,计算合金中铁的质量分数可能会偏低,原因是空气中CO2、水蒸气进入E管使b增大。你认为改进的方法是________________________________________。
(5)乙同学认为,即使甲同学认为的偏差得到改进,依据此实验测得合金中铁的质量分数也可能会偏高。你认为其中的原因是________________________________________________________。
Ⅱ.探究浓硫酸的某些性质:
(6)往A中滴加足量的浓硫酸,未点燃酒精灯前,A、B均无明显现象,其原因是:_______________________________________。
(7)A中铁与浓硫酸发生反应的化学方程式是_______________________。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com