
| A、标况下,22.4L CO和CO2的混合气体中所含的碳原子数一定是NA |
| B、常温常压下,11.2L H2O所含氧原子数都是0.5NA |
| C、1mol Fe足量纯氧点燃,Fe所失去的电子数为3NA |
| D、100mL 1mol/L NaCl溶液与50mL 1 mol/L AlCl3溶液中Cl-物质的量浓度相等 |
| 8 |
| 3 |
| 8 |
| 3 |
| 8 |
| 3 |


 备战中考寒假系列答案
备战中考寒假系列答案科目:高中化学 来源: 题型:
 某温度时,在一个5L的恒容容器中,X、Y、Z均为气体,三种物质的物质的量随时间的变化曲线如图所示.根据图中数据填空:
某温度时,在一个5L的恒容容器中,X、Y、Z均为气体,三种物质的物质的量随时间的变化曲线如图所示.根据图中数据填空:查看答案和解析>>
科目:高中化学 来源: 题型:
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、原电池的正极和电解池的阳极均发生氧化反应 |
| B、氢燃料电池的正极是通入氢气的那一极 |
| C、镀层破损后,白铁(镀锌的铁)比马口铁(镀锡的铁)耐腐蚀 |
| D、铅蓄电池充电时电源的正极接蓄电池标“-”的一极 |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、22.4LSO2与0.5molO2混合催化氧化,生成NA个SO3分子 |
| B、1mol乙炔在空气中燃烧,一定生成2NA个CO2分子 |
| C、1molCl2与1molCH4恰好完全反应,则转移的电子总数为2NA |
D、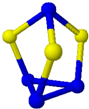 11g某硫化磷(如图)中含P-S键数目为0.45NA |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、节能减排符合低碳经济的要求 |
| B、废旧金属的回收利用有利于节约矿物资源和能源 |
| C、合理开发利用可燃冰有助于缓解能源紧缺 |
| D、毒馒头与瘦肉精事件说明化学品的危害,我们应该拒绝一切化学添加剂的使用 |
查看答案和解析>>
科目:高中化学 来源: 题型:
| 实验编号 | HA物质的量浓度(mol?L-1) | NaOH物质的量浓度(mol?L-1) | 混合溶液 的pH |
| a | 0.1 | 0.1 | pH=9 |
| b | c | 0.2 | pH=7 |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、该溶液中由水电离出的c(H+)=1×10-3mol?L-1 |
| B、pH=2的HA溶液与pH=3的HCl溶液:c(HA)=10 c(HCl) |
| C、pH=3的HA溶液与pH=11的NaOH溶液等体积混合后所得的溶液中:c(Na+)>c(A-)>c(OH-)>c(H+) |
| D、0.1mol?L-1HA溶液与0.05mol?L-1NaOH溶液等体积混合后所得的溶液中:c(A-)+c(HA)=0.05mol?L-1 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com