
| A. | ①⑧ | B. | ③⑩ | C. | ①⑥ | D. | ②⑨ |
 夺冠训练单元期末冲刺100分系列答案
夺冠训练单元期末冲刺100分系列答案 新思维小冠军100分作业本系列答案
新思维小冠军100分作业本系列答案 名师指导一卷通系列答案
名师指导一卷通系列答案科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
| 温度/℃ | 400 | 500 | 800 |
| 平衡常数K | 9.94 | 9 | 1 |
| 实验序号 | 反应温度/℃ | H2C2O4溶液 | 酸性KMO4溶液 | H2O | ||
| V/mL | c/(mol•L-1) | V/mL | c/(mol•L-1) | V/mL | ||
| ① | 25 | 8.0 | 0.20 | 5.0 | 0.010 | 0 |
| ② | 25 | 6.0 | 0.20 | 5.0 | 0.010 | x |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 淀粉检验方法:加碘化钾变蓝 | B. | 蛋白质检验方法:浓硝酸或燃烧法 | ||
| C. | 蛋白质最终水解产物:葡萄糖 | D. | 淀粉最终水解产物:二氧化碳 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | Cu+S$\frac{\underline{\;\;△\;\;}}{\;}$CuS | B. | 3Cu+8HNO3(浓)═3Cu(N03)2+2N0↑+4H20 | ||
| C. |  +HO-NO2$\stackrel{浓硫酸}{→}$ +HO-NO2$\stackrel{浓硫酸}{→}$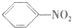 +H2O +H2O | D. | 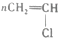 $\stackrel{引发剂}{→}$ $\stackrel{引发剂}{→}$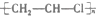 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
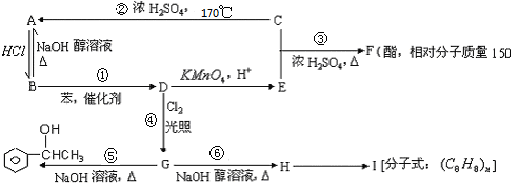
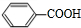
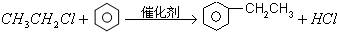
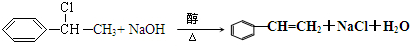
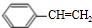 $\stackrel{催化剂}{→}$
$\stackrel{催化剂}{→}$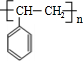 .
.查看答案和解析>>
科目:高中化学 来源: 题型:填空题
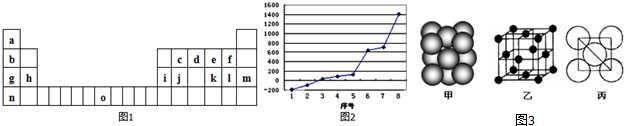
 ,它在常温下呈液态,形成晶体时,属于
,它在常温下呈液态,形成晶体时,属于查看答案和解析>>
科目:高中化学 来源: 题型:解答题
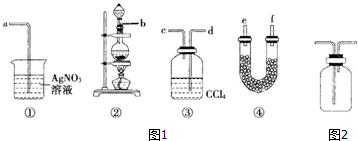
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | s能级原子轨道呈球形,其电子运动轨迹呈球形 | |
| B. | P能级轨道数随电子层数递增而增多 | |
| C. | 在基态多电子原子中,N层上的电子能最一定比M层上的高 | |
| D. | 在基态多电子原子中,不可能有两个运动状态完全相同的电子 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com