
【题目】卤素及其化合物在工农业生产和人类生活中都有着重要的应用。
(1)碘是人体不可缺乏的元素,为了防止碘缺乏,现在市场上流行一种加碘盐,就是在精盐中添加一定量的KIO3进去。某研究小组为了检测某加碘盐中是否含有碘,查阅了有关的资料,发现其检测原理是:KIO3+5KI+3H2SO4=3I2+3H2O+3K2SO4
①氧化剂与还原剂的物质的量比是_______;如果反应生成0.3mol的单质碘,则转移的电子数目是_______。
②先取少量的加碘盐加蒸馏水溶解,然后加入稀硫酸和KI溶液,最后加入一定量的CCl4,振荡,这时候,观察到的现象是_____;
③若采用下图实验装置将四氯化碳和I2的混合溶液分离。
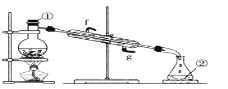
写出图中仪器的名称:①_____;该装置还缺少的仪器是_____;冷凝管的进水口是:_____(填g或f)。
(2)实验室常用MnO2和浓盐酸制氯气,反应原理:MnO2+4HCl(浓)![]() MnCl2+Cl2↑+2H2O
MnCl2+Cl2↑+2H2O
①实验室用MnO2和浓盐酸制氯气的离子方程式:__________________________
②上述反应中氧化剂:__________,还原剂:__________,被氧化的HCl和未被氧化的HCl的比值______________。
③a : Cl2+2I-=I2+2Cl-; b: Cl2+2Fe2+=2Fe3++Cl-; c:2Fe3++2I-=I2+2Fe2+。 Cl2、I2、Fe3+的氧化性由强到弱的顺序:_________________________
【答案】1:5 0.5NA 溶液分层,下层液为紫红色 蒸馏烧瓶 温度计 g MnO2+4H++2Cl-(浓)![]() Mn2++Cl2↑+2H2O MnO2 HCl 1:1 Cl2>Fe3+>I2
Mn2++Cl2↑+2H2O MnO2 HCl 1:1 Cl2>Fe3+>I2
【解析】
(1)①KIO3+5KI+3H2SO4→3I2+3K2SO4+3H2O中,I元素的化合价由+5价降低为0,I元素的化合价由-1价升高为0,化合价升高值=化合价降低值=转移电子数,根据化合价变化确定电子转移情况;
②碘易溶于有机溶剂,在四氯化碳在的溶解度远大于在水中,加入四氯化碳萃取水中的碘,四氯化碳与水不互溶,溶液分成两层,四氯化碳的密度比水,有机层在下层,碘溶于四氯化碳呈紫红色,上层几乎无色;
③依据蒸馏的正确操作与注意事项分析;
(2)①实验室常用MnO2和浓盐酸制氯气;
②依据氧化还原反应的规律分析;
③依据氧化剂的氧化性大于氧化产物的氧化性分析作答;
(1)①反应中氧化剂为KIO3,还原剂为KI,氧化剂与还原剂的物质的量比是1:5;生成3molI2,电子转移5mol,生成0.3mol的单质碘转移的电子0.5mol,转移的电子的数目为0.5NA;
②溶液分层且I2溶于CCl4中呈紫色,密度较大,因此观察到的现象是溶液分层,下层液为紫红色;
③该图为蒸馏装置①是蒸馏烧瓶,②是锥形瓶;在蒸馏时需要测量温度,还需要温度计;冷凝水进出水方向为“下进上出”,即g口为进水口;
(2)①实验室常用MnO2和浓盐酸制氯气,反应原理:MnO2+4HCl(浓)![]() MnCl2+Cl2↑+2H2O,离子反应为:MnO2+4H++2Cl-(浓)
MnCl2+Cl2↑+2H2O,离子反应为:MnO2+4H++2Cl-(浓)![]() Mn2++ Cl2↑+2H2O;
Mn2++ Cl2↑+2H2O;
②反应中Mn元素化合价从+4价降低到+2价,Cl元素化合价从-1价升高到0价,MnO2作氧化剂,HCl作还原性,盐酸具有还原性和酸性,且被氧化的HCl和未被氧化的HCl的比值为1:1;
③a反应中Cl2作氧化剂,I2为氧化产物,氧化性Cl2> I2,b反应中Cl2作氧化剂,Fe3+为氧化产物,氧化性Cl2> Fe3+,c反应中Fe3+作氧化剂,I2为氧化产物,氧化性Fe3+> I2,综上,氧化性Cl2>Fe3+>I2。


科目:高中化学 来源: 题型:
【题目】改良Claus法利用天然气脱硫产生的H2S回收单质硫,首先将原料气通入反应炉并发生高温反应Ⅰ:2H2S(g) + 3O2(g) =2SO2(g) + 2H2O(g);反应后的混合气体通入串联的多个温度逐渐降低的转化器内进行反应Ⅱ:2H2S(g) + SO2(g)![]() 3S(l) + 2H2O(g)。下列说法正确的是
3S(l) + 2H2O(g)。下列说法正确的是
A.反应Ⅰ、Ⅱ消耗等量H2S时,转移电子数之比为2:1
B.根据工艺流程判断反应Ⅱ为吸热反应
C.通过串联多个转化器可提高硫的回收率
D.反应Ⅰ中消耗H2S的量占通入H2S总量的![]() 时,硫的回收率最高
时,硫的回收率最高
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】已知合成氨反应的化学方程式为3H2(g)+N2(g)![]() 2NH3(g),下列说法能表示合成氨反应达到化学平衡状态的是
2NH3(g),下列说法能表示合成氨反应达到化学平衡状态的是
A. v逆(N2)=3v正( H2)
B. 三个H—H 键断裂的同时有六个N—H 键生成
C. NH3的百分含量保持不变
D. c(N2) : c(H2) : c(NH3)=1 : 3 : 2
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】氯气是一种重要的化工原料,在生活和生产中的应用十分广泛。
请回答:
(1)在工业上,“氯碱工业”是生产氯气的主要方法。请写出工业制备氯气的离子方程式__________________________。
(2)实验室常用MnO2 与浓盐酸反应制备Cl2,装置如图1所示:
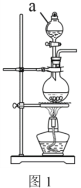
仪器a的名称为______。制备实验开始时,先检査装置气密性,接下来的操作依次是:___________(填序号)。
①往烧瓶中加入MnO2粉末 ②加热 ③往烧瓶中加入浓盐酸
(3)为证明Cl2与H2O反应为可逆反应,将生成的气体通入图2所示装置:

①装置A中应加入的试剂是____________。
②证明可逆反应,需验证在B中反应物和生成物同时存在,证明氯水中有Cl2存在的现象是______,仅使用一种试剂证明氯水中HCl和HClO均存在,合适的试剂是_____。
A.AgNO3溶液 B.石蕊试液
C.NaOH溶液 D.品红溶液
③装置C中NaOH溶液的作用是___________________。
(4)制备反应会因盐酸浓度下降而停止,为测定反应残余液中盐酸的浓度(残余液体积已知)。甲同学提出下列具体方案。请你从下列实验方案中选择合理的实验方法______。
A.在残余液中加入足量AgNO3溶液,过滤,洗涤,干燥,称量沉淀的质量
B.在残余液中加入足量NaHCO3固体,将反应后的气体直接用碱石灰吸收,测定生成的气体的质量
C.在残余液中加入足量锌片,测量生成气体的体积,折算成标准状况下的体积
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】聚合物 L(![]() )是一种聚酰胺纤维,广泛用于各种刹车片,其合成路线如图:
)是一种聚酰胺纤维,广泛用于各种刹车片,其合成路线如图:

已知:①C、D、K 均为芳香族化合物,分子中均只含两种不同化学环境的氢原子。
②Diels﹣Alder 反应![]() +
+![]()
![]()
![]()
③ R2Cl![]() R1OR2
R1OR2
(1)I→J 的反应类型是________,D 的名称是________,G 中所含官能团的名称是________。
(2)B 的结构简式是________,“B→C”的反应中,除 C 外,另外一种产物是________。
(3)D+K→L 的化学方程式是________。
(4)M 为 D 的同分异构体,同时满足下列条件的 M 的结构简式为________。
①1 molM 最多消耗 4 mol NaOH ②核磁共振氢谱有 4 组吸收峰
(5)N 是 D 的同系物,相对分子质量比 D 大 14,则 N 可能的结构有________种。
(6)已知:乙炔与 1,3﹣丁二烯也能发生 Diels﹣Alder 反应。请以 1,3﹣丁二烯和乙炔为原料,选用必要的无机试剂合成 ,写出合成路线:________ (用结构简式表示有机物,用箭头表示转化关系,箭头上注明试剂和反应条件)。
,写出合成路线:________ (用结构简式表示有机物,用箭头表示转化关系,箭头上注明试剂和反应条件)。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】(1)SO2和SO3是硫的两种氧化物,等温等压下,等质量的SO2和SO3所含分子个数比为________,氧原子个数比为________,等温等压下气体体积比_____________。
(2)100mL的某气体的质量为0.143g,该气体的相对分子质量:______________,
(3)设NA为阿伏加德罗常数的数值,如果ag某气体中含有的分子数为b,则cg该气体在标准状况下的体积约是___________L(用含NA的式子表示)。
(4)配制100 mL1 mol/L的H2SO4溶液,需要用量筒量取浓H2SO4(密度为1.84g·mL-1,质量分数为98%)的体积为__________mL。
(5)10.6gNa2CO3溶于水,配成500mL的溶液,溶液中溶质的物质的量________,Na+的物质的量浓度______________。
(6)标准状况下,5.6LNH3中氢原子的数目为_________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】无色气体A在一种黄绿色气体B中可以安静的燃烧,发出苍白色火焰,反应生成气体C.B与金属D反应可生成白色固体E,D在空气中燃烧生成浅黄色固体F,D与水反应又可生成A.试回答下列问题:

(1)写出下列物质的化学式:B________、C_________、E___________。
(2)写出B与水反应的离子方程式:_________________________________
(3)为了验证Fe3+的性质,某化学兴趣小组设计了如图所示的一组实验,实验方案设计错误的是____(填字母)
A.④和⑤ B.只有③ C.③和④ D.①②③
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】[化学——选修3:物质结构与性质]碳及其化合物广泛存在于自然界中,回答下列问题:
(1)处于一定空间运动状态的电子在原子核外出现的概率密度分布可用___________形象化描述。在基态原子中,核外存在______对自旋相反的电子。
(2)碳在形成化合物时,其键型以共价键为主,原因是_____________。
(3)CS2分子中,共价键的类型有_____________,C原子的杂化轨道类型是_______,写出两个与CS2具有相同空间构型和键合形式的分子或离子_______________。
(4)CO能与金属Fe形成Fe(CO)5,该化合物的熔点为253K,沸点为376K,其固体属于_____晶体。
碳有多种同素异形体,其中石墨烯与金刚石的晶体结构如图所示:
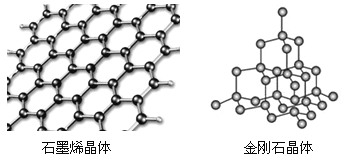
①在石墨烯晶体中,每个C原子连接_____个六元环,每个六元环占有___个C原子。
②在金刚石晶体中,C原子所连接的最小环也为六元环,每个C原子连接________个六元环,六元环中最多有________个C原子在同一平面。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某氧原子的质量是a g,12C原子的质量是b g,用NA表示阿伏加德罗常数的值,下列说法中正确的是( )
①该氧原子的相对原子质量为12a/b
②m g该氧原子的物质的量为m/(aNA) mol
③该氧原子的摩尔质量是aNA g
④a g该氧原子所含的电子数为8 mol
A. ①③B. ②④C. ①②D. ②③
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com