
【题目】SO2是危害最为严重的大气污染物之一,SO2的含量是衡量大气污染的一个重要指标。工业上常采用催化还原法或吸收法处理SO2。催化还原SO2不仅可以消除SO2污染,而且可得到有价值的单质S。
(1)在复合组分催化剂作用下,CH4可使SO2转化为S,同时生成CO2和H2O。已知CH4和S的燃烧热分别为890.3kJ/mol和297.2kJ/mol,CH4和SO2反应的热化学方程式为______________________。
(2)用H2还原SO2生成S的反应分两步完成,如图1所示,该过程中相关物质的物质的量浓度随时间的变化关系如图2所示:
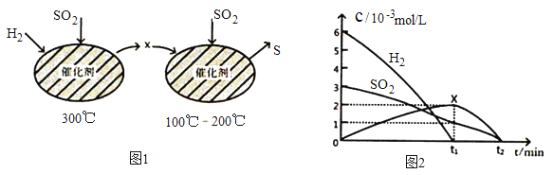
①分析可知X为____________(写化学式),0~t1时间段的温度为_________,0~t1时间段用SO2表示的化学反应速率为________________________________。
②总反应的化学方程式为_______________________________。
(3)工业上可用Na2SO3溶液吸收SO2,该反应的离子方程式为__________________________,比较Na2SO3溶液中各离子浓度的大小关系为__________________。
【答案】 CH4 (g)+2SO2 (g)=== CO2 (g)+2S (s)+2H2O(l) △H=-295.9 kJ/mol H2S 300℃ 2×10-3/t1 mol/(L· min) 2H2+SO2 === S+2H2O SO32- +SO2 + H2O === 2HSO3- c(Na+)>>c(SO32-)>c(OH-)>c(HSO3-)>c(H+)
【解析】本题以消除大气污染物SO2的各种方法讨论为基础,主要考查盖斯定律、热化学方程式、质量守恒定律、化学反应速率计算、离子方程式、离子浓度大小比较等基础知识,考查考生的读图能力、对化学反应过程的综合分析能力和化学知识的综合运用能力。
解析:(1)根据已知可得CH4(g)+2O2(g)=CO2(g)+2H2O(l) △H=-890.3 kJ/mol……①、S(s)+O2(g)=SO2(g) △H=-297.2 kJ/mol……②,CH4使SO2转化为S的反应原理是CH4+2SO2=2S+CO2+2H2O,反应①-②×2得CH4(g)+2SO2(g)=2S(s)+CO2(g)+2H2O(l) △H=-295.9 kJ/mol。正确答案:CH4(g)+2SO2(g)=2S(s)+CO2(g)+2H2O(l) △H=-295.9 kJ/mol。(2)第一步300℃时,对应图2 的0~t1时间段,通过读图可知参加反应的H2 6×10-3mol/L、SO2 (3-1)×10-3mol/L、生成X 2×10-3mol/L,因此反应过程中这三种物质的计量系数之比为3:1:1,既3H2+SO2→X……③。同理100~200℃反应为2X+SO2→S……④。H2还原SO2生成S的同时产生H2O,既SO2+2H2=S+2H2O,所以反应④参加反应的O元素生成H2O,反应④为2X+SO2=S+2H2O,根据质量守恒定律X为H2S。0~t1时间段用SO2表示的化学反应速率为![]() 。正确答案:H2S、300℃、
。正确答案:H2S、300℃、![]() 、SO2+2H2=S+2H2O。(3)Na2SO3吸收SO2反应生成NaHSO3,反应离子方程式为SO32-+SO2+H2O =2HSO3-。Na2SO3溶液中,Na2SO3=2Na++SO32-,SO32-+H2O
、SO2+2H2=S+2H2O。(3)Na2SO3吸收SO2反应生成NaHSO3,反应离子方程式为SO32-+SO2+H2O =2HSO3-。Na2SO3溶液中,Na2SO3=2Na++SO32-,SO32-+H2O![]() HSO3-+OH-、HSO3-+H2O
HSO3-+OH-、HSO3-+H2O![]() H2SO3+OH-, H2O
H2SO3+OH-, H2O![]() H++OH-,其中SO32-水解只占总SO32-的一小部分,HSO3-水解只占第一步水解生成的总HSO3-的一小部分,且SO32-水解程度大于HSO3-。所以溶液中各离子浓度大小关系为c(Na+)>c(SO32-)>c(OH-)>c(HSO3-)>c(H+)。正确答案:SO32-+SO2+H2O =2HSO3-、c(Na+)>c(SO32-)>c(OH-)>c(HSO3-)>c(H+)。
H++OH-,其中SO32-水解只占总SO32-的一小部分,HSO3-水解只占第一步水解生成的总HSO3-的一小部分,且SO32-水解程度大于HSO3-。所以溶液中各离子浓度大小关系为c(Na+)>c(SO32-)>c(OH-)>c(HSO3-)>c(H+)。正确答案:SO32-+SO2+H2O =2HSO3-、c(Na+)>c(SO32-)>c(OH-)>c(HSO3-)>c(H+)。


 阅读快车系列答案
阅读快车系列答案科目:高中化学 来源: 题型:
【题目】实验题
Ⅰ.课本实验
(1)苯甲酸的重结晶实验操作步骤是_________、__________、__________、分离晶体,粗苯甲酸溶解后还要加点水的目的是________________。
(2)为了验证溴乙烷中含有溴元素,有以下操作:①加硝酸银溶液 ②加NaOH溶液 ③加热 ④加蒸馏水 ⑤加硝酸至溶液显酸性,合理的顺序是(______)
A、②①③⑤ B、②④⑤③ C、②③⑤① D、②①⑤③
(3)在溴乙烷与NaOH乙醇溶液的消去反应中可以观察到有气体生成。有人设计了实验方案来检验生成的气体是否为乙烯,如图所示。

①Ⅰ中水的作用____________。
②Ⅱ中还可用________________,若用此物质,此时______(填“有”或“无”)必要将气体先通入水中。
Ⅱ.拓展实验
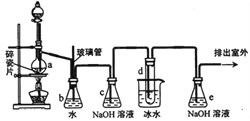
1,2一二溴乙烷可作抗爆剂的添加剂。下图为实验室制备1,2一二溴乙烷的装置图,图中分液漏斗和烧瓶a中分别装有浓H2SO4和无水乙醇,试管d中装有液溴。
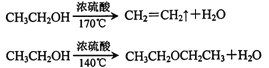
已知:
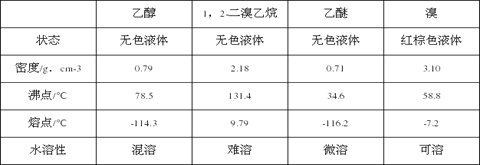
相关数据列表如下:
(1)实验中应迅速将温度升高到170℃左右的原因是__________________。
(2)安全瓶b在实验中有多重作用。其一可以检查实验进行中导管d是否发生堵塞,请写出发生堵塞时瓶b中的现象__________________;如果实验中导管d堵塞,你认为可能的原因是__________________;安全瓶b还可以起到的作用是___________________________;
(3)容器c、e中都盛有NaOH溶液,c中NaOH溶液的作用是_______________;
(4)某学生在做此实验时,使用一定量的液溴,当溴全部褪色时,所消耗乙醇和浓硫酸混合液的量,比正常情况下超过许多,如果装置的气密性没有问题,试分析可能的原因___________________________;
(5)除去产物中少量未反应的Br2后,还含有的主要杂质为_______,要进一步提纯,下列操作中必须的是__________________(填入正确选项前的字母)。
A. 重结晶 B.过滤 C.萃取 D.蒸馏
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】Ⅰ.根据下列各题中所给出的数据,可分别求出其溶液的“溶质质量分数”或溶液的“物质的量浓度”,试求解。
(1)已知某氢氧化钠溶液V L中含有N个氢氧根离子,可求出此溶液的物质的量浓度是________。
(2)已知某氢氧化钠溶液中Na+与H2O的个数之比为1∶a,则可求出此溶液的溶质的质量分数为________。
Ⅱ.常温下,10.0 mL 1.0 mol·L-1的H2SO4(aq),加水稀释到500 mL,所得H2SO4(aq)的浓度为________mol·L-1;蒸发浓缩,使溶液的体积为2.40 mL,所得H2SO4(aq)的浓度为____mol·L-1。
Ⅲ.已知标准状况下1体积水能溶解500体积的氯化氢,得到密度为1.19g/mL的盐酸,则可求出标准状况下氯化氢饱和溶液中溶质的质量分数为______,该盐酸的浓度为_____(结果均保留一位小数)。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】世界某著名学术刊物近期介绍了一种新型中温全瓷铁一空气电池,其结构如图所示。

下列有关该电池放电时的说法正确的是
A. O2-由b极移向a极
B. 正极的电极反应式为FeOx+2xe-=Fe+xO2-
C. 铁表面发生的反应为xH2O(g)+Fe=FeOx+xH2
D. 若有22.4L(标准状况)空气参与反应,则电路中有4mol电子转移
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】有人设计了如图所示实验装置,目的是做钠与水反应实验,并验证①钠的物理性质;②钠与水反应的产物是什么。

(1)当进行适当操作时还需要的仪器有________。
(2)如何进行操作?__________。
(3)实验现象是_______________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列关于化学键的说法正确的是
A. 构成单质分子的微粒一定含有共价键
B. 不同元素组成的多原子分子里的化学键一定都是极性键
C. 非极性键只存在于双原子单质分子中
D. 全部由非金属元素组成的化合物不一定是共价化合物
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】立方氮化硼CBN( Cubic Boron Nitrde)的硬度仅次于金刚石而远远高于其它材料,因此它与金刚石统称为超硬材料,具有优异的耐磨性。其晶体结构如下图所示:
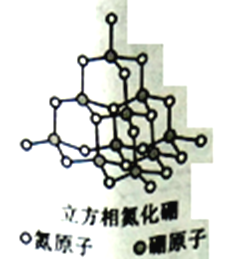
(1)基态氮原子的价电子层排布式是_____________,在氮和硼原子所在的周期中,第一电离能小于氮原子的有_____种元素的原子。
(2)氮原子和硼原子形成的化学键类型有_____________________。
(3)硼原子的杂化类型是_______,与硼原子紧相连的4个氮原子的空间构型是________,键角是_______ 。
(4)晶胞如图所示,该晶体属于______晶体。
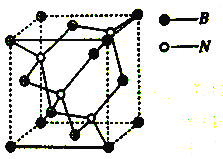
(5)晶体中所连接的最小环上是六元环,每个硼原子被_____个六元环共用,六元环最多有_____个原子在同一平面上。若晶胞边长为apm,立方氮化硼的密度是ρg/cm3,则NA的表达式是____(用a和ρ表示)。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】从海水得到的粗食盐水中常含Ca2+、Mg2+、SO42-,需要分离提纯。现有含少量CaCl2、MgSO4的粗食盐水,在除去悬浮物和泥沙之后,要用4种试剂:①盐酸、②Na2CO3、③NaOH、④BaCl2来除去食盐水中的Ca2+、Mg2+、SO42-。提纯时的操作步骤和加入试剂的情况如图。

图中a、b、c、d分别表示上述4种试剂中的一种,请回答:
(1)沉淀A的名称是________。
(2)试剂d是________;判断试剂d已经足量的方法是__________________________。
(3)加入b、c后溶液中发生的化学反应的化学方程式有______________________(任写两个)。
(4)现有下列仪器,过滤出沉淀A、B、C时必须用到的是____(填序号),仪器③的名称是_______。

查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com