
(8分)电镀广泛地应用于工业生产中。在电镀铬的工业废水中主要含有Cr3+,同时还含有少量的Cu2+、Fe2+ 、Fe3+和Al3+等,且酸性较强。为回收利用铬元索,此工业废水通常采用如下流程处理:
已知:
(1) 铬元素有以下循环过程:
(2) Cu(OH)2能溶于氨水:
请回答下列问题:
(1)加入试剂甲的目的:________________
(2)试剂乙的名称:__________ ,试剂丙的化学式:________________
(3) 上述操作I、II、III相同,则进行该实验操作所需要的主要玻璃仪器有___________
(4)滤渣I的主要成分为________________(写化学式)。
(5)在铬元素循环过程的反应①中每反应掉1 mol H2O2同时消耗H+数目为:________________
(6) 铬元素循环过程的反应⑥的离子方程式:________________;废水处理流程中生成滤渣III的离子方程式:________
 课时掌控随堂练习系列答案
课时掌控随堂练习系列答案 一课一练一本通系列答案
一课一练一本通系列答案 浙江之星学业水平测试系列答案
浙江之星学业水平测试系列答案科目:高中化学 来源:2013届山西省康杰中学等四校高三第一次联考化学试卷(带解析) 题型:填空题
(共10分)甲醇合成反应及其能量变化如图所示:
(1)写出合成甲醇的热化学方程式________________________________。
实验室在1 L的密闭容器中进行模拟合成实验。将1 mol CO和2 mol H2通入容器中,分别恒温在300 ℃和500 ℃反应,每隔一段时间测得容器内CH3OH的浓度如下表所示:
| 时间浓度(mol/L)温度 | 10 min | 20 min | 30 min | 40 min | 50 min | 60 min |
| 300 ℃ | 0.40 | 0.60 | 0.75 | 0.84 | 0.90 | 0.90 |
| 500 ℃ | 0.60 | 0.75 | 0.78 | 0.80 | 0.80 | 0.80 |
查看答案和解析>>
科目:高中化学 来源:2012届新疆兵团二中高三第一次月考化学试卷 题型:填空题
(8分)电镀广泛地应用于工业生产中。在电镀铬的工业废水中主要含有Cr3+,同时还含有少量的Cu2+、Fe2+、Fe3+和Al3+等,且酸性较强。为回收利用铬元索,此工业废水通常采用如下流程处理: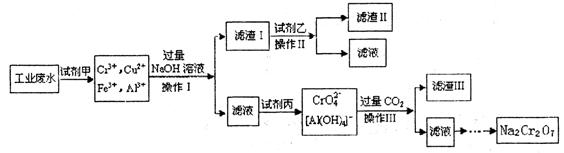
已知:
(1) 铬元素有以下循环过程: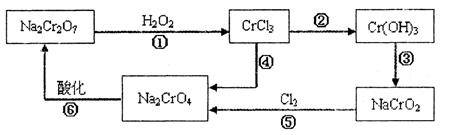
(2) Cu(OH)2能溶于氨水:
请回答下列问题:
(1)加入试剂甲的目的:________________
(2)试剂乙的名称:__________ ,试剂丙的化学式:________________
(3) 上述操作I、II、III相同,则进行该实验操作所需要的主要玻璃仪器有___________
(4)滤渣I的主要成分为________________(写化学式)。
(5)在铬元素循环过程的反应①中每反应掉1 mol H2O2同时消耗H+数目为:________________
(6) 铬元素循环过程的反应⑥的离子方程式:________________;废水处理流程中生成滤渣III的离子方程式:________
查看答案和解析>>
科目:高中化学 来源:2012-2013学年山西省等四校高三第一次联考化学试卷(解析版) 题型:填空题
(共10分)甲醇合成反应及其能量变化如图所示:

(1)写出合成甲醇的热化学方程式________________________________。
实验室在1 L的密闭容器中进行模拟合成实验。将1 mol CO和2 mol H2通入容器中,分别恒温在300 ℃和500 ℃反应,每隔一段时间测得容器内CH3OH的浓度如下表所示:
|
时间浓度(mol/L)温度 |
10 min |
20 min |
30 min |
40 min |
50 min |
60 min |
|
300 ℃ |
0.40 |
0.60 |
0.75 |
0.84 |
0.90 |
0.90 |
|
500 ℃ |
0.60 |
0.75 |
0.78 |
0.80 |
0.80 |
0.80 |
(2)在300 ℃反应开始10 min内,H2的平均反应速率为v(H2)=________。
(3)在500 ℃达到平衡时,平衡常数K=________。
(4)在另一体积不变的密闭容器中,充入1.2 mol CO和2.0 mol H2,一定条件下达到平衡,测得容器中压强为起始压强的一半。计算该条件下H2的转化率为________。
(5)铜基催化剂具有活性高、选择性好和条件温和的特点,已广泛地使用于CO/CO2的加氢合成甲醇。该反应中a的大小对反应热ΔH有无影响,___________________________。
查看答案和解析>>
科目:高中化学 来源:2011-2012学年新疆兵团二中高三第一次月考化学试卷 题型:填空题
(8分)电镀广泛地应用于工业生产中。在电镀铬的工业废水中主要含有Cr3+,同时还含有少量的Cu2+、Fe2+ 、Fe3+和Al3+等,且酸性较强。为回收利用铬元索,此工业废水通常采用如下流程处理:

已知:
(1) 铬元素有以下循环过程:

(2) Cu(OH)2能溶于氨水:

请回答下列问题:
(1)加入试剂甲的目的:________________
(2)试剂乙的名称:__________ ,试剂丙的化学式:________________
(3) 上述操作I、II、III相同,则进行该实验操作所需要的主要玻璃仪器有___________
(4)滤渣I的主要成分为________________(写化学式)。
(5)在铬元素循环过程的反应①中每反应掉1 mol H2O2同时消耗H+数目为:________________
(6) 铬元素循环过程的反应⑥的离子方程式:________________;废水处理流程中生成滤渣III的离子方程式:________
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com