
 已知可逆反应:mA(g)+nB(1)?pC(g).改变温度(其他条件不变)、压强(其他条件不变)对上述反应正逆反应速率的影响分别如图所示,以下叙述正确的是( )
已知可逆反应:mA(g)+nB(1)?pC(g).改变温度(其他条件不变)、压强(其他条件不变)对上述反应正逆反应速率的影响分别如图所示,以下叙述正确的是( )| A、m>p,正反应为放热反应 |
| B、m<p,正反应为吸热反应 |
| C、m+n<p,正反应为放热反应 |
| D、m+n<p,正反应为吸热反应 |
科目:高中化学 来源: 题型:
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、取样,加入氯化钡溶液有白色沉淀产生,再加盐酸,沉淀不消失,一定有SO42- |
| B、取样,加入硝酸银有白色沉淀,一定有Cl- |
| C、取样,加入碳酸钠溶液产生白色沉淀,再加盐酸白色沉淀消失,一定有Ba2+ |
| D、取样,滴加KSCN溶液,不显红色,再滴加氯水后显红色,一定有Fe2+ |
查看答案和解析>>
科目:高中化学 来源: 题型:

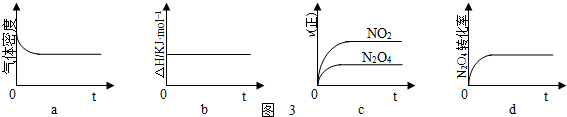
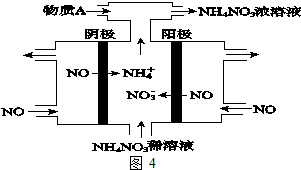
查看答案和解析>>
科目:高中化学 来源: 题型:
| 物质 | 颜色、性质 | 物质 | 颜色、性质 | |
| 氢氧化铜Cu(OH)2 | 蓝色固体不溶于水 | 硫酸铜(CuSO4) | 溶液呈蓝色 | |
| 氧化亚铜(Cu2O) | 红色固体不溶于水 | 氯化铜(CuCl2) | 溶液呈绿色,稀溶液呈蓝色 | |
| 氯化亚铜(CuCl) | 白色固体不溶于水 | 碱式氯化铜 | 绿色固体不溶于水 |
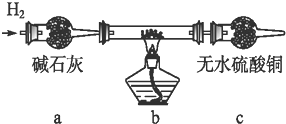 实验结束后,碳棒上的白色物质变为红色,无水硫酸铜不变色.
实验结束后,碳棒上的白色物质变为红色,无水硫酸铜不变色.查看答案和解析>>
科目:高中化学 来源: 题型:
| A、AgCl沉淀溶解平衡正向移动 |
| B、AgCl溶解度增大 |
| C、溶液中c(Ag+)增大 |
| D、溶液中c(Cl-)增大 |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、2NO2?N2O4 (正反应为放热反应) |
| B、C(s)+CO2?2CO (正反应为吸热反应) |
| C、N2+3H2?2NH3 (正反应为放热反应) |
| D、H2S?H2+S(s)(正反应为吸热反应) |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、H2S分子中,S为sp杂化,为直线形 |
| B、BCl3中B原子sp2杂化,为平面三角形 |
| C、CS2中C原子sp杂化,为直线形 |
| D、PCl3中P原子sp3杂化,为三角锥形 |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、K+、Ba2+、NO3-、Cl- |
| B、H+、Fe2+、ClO-、Cl- |
| C、Na+、Ag+、Cl-、SO42- |
| D、Al3+、Na+、HCO3-、SO42- |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com