
¹ŲÓŚĻĀĮŠø÷Ķ¼µÄŠšŹöÕżČ·µÄŹĒ

A£®¼×±ķŹ¾H2ÓėO2·¢Éś·“Ó¦¹ż³ĢÖŠµÄÄÜĮæ±ä»Æ£¬ŌņH2µÄ±ź×¼Č¼ÉÕČČĪŖ”÷H=£483.6kJ”¤mol-1
B£®ŅŅ±ķŹ¾ŗćĪĀŗćČŻĢõ¼žĻĀ·¢ÉśµÄæÉÄę·“Ó¦2NO2 N2O4(g)ÖŠ£¬ø÷ĪļÖŹµÄÅضČÓėĘäĻūŗÄĖŁĀŹÖ®¼äµÄ¹ŲĻµ£¬ĘäÖŠ½»µćA¶ŌÓ¦µÄדĢ¬ĪŖ»ÆŃ§Ę½ŗāדĢ¬
N2O4(g)ÖŠ£¬ø÷ĪļÖŹµÄÅضČÓėĘäĻūŗÄĖŁĀŹÖ®¼äµÄ¹ŲĻµ£¬ĘäÖŠ½»µćA¶ŌÓ¦µÄדĢ¬ĪŖ»ÆŃ§Ę½ŗāדĢ¬
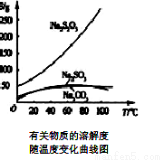
C£®±ū±ķŹ¾A”¢BĮ½ĪļÖŹµÄČܽā¶ČĖęĪĀ¶Č±ä»ÆĒéæö£¬½«tl”ꏱA”¢BµÄ±„ŗĶČÜŅŗ·Ö±šÉżĪĀÖĮt2”ꏱ£¬ČÜÖŹµÄÖŹĮæ·ÖŹżB>A
D£®¶”±ķŹ¾³£ĪĀĻĀ£¬Ļ”ŹĶHA”¢HBĮ½ÖÖĖįµÄĻ”ČÜŅŗŹ±£¬ČÜŅŗpHĖę¼ÓĖ®ĮæµÄ±ä»Æ£¬ŌņNaAČÜŅŗµÄpHŠ”ÓŚĶ¬ÅØ¶ČµÄNaBČÜŅŗµÄpH

| Äź¼¶ | øßÖŠæĪ³Ģ | Äź¼¶ | ³õÖŠæĪ³Ģ |
| øßŅ» | øßŅ»Ćā·ŃæĪ³ĢĶĘ¼ö£” | ³õŅ» | ³õŅ»Ćā·ŃæĪ³ĢĶĘ¼ö£” |
| ø߶ž | ø߶žĆā·ŃæĪ³ĢĶĘ¼ö£” | ³õ¶ž | ³õ¶žĆā·ŃæĪ³ĢĶĘ¼ö£” |
| øßČż | øßČżĆā·ŃæĪ³ĢĶĘ¼ö£” | ³õČż | ³õČżĆā·ŃæĪ³ĢĶĘ¼ö£” |
æĘÄæ£ŗøßÖŠ»Æѧ Ą“Ō“£ŗ2015-2016ѧğ¼ŖĮÖŹ”ø߶žÉĻѧʌµŚČż“ĪŌĀæ¼»ÆѧŹŌ¾ķ£Ø½āĪö°ę£© ĢāŠĶ£ŗŃ”ŌńĢā
³£ĪĀĻĀijČÜŅŗÖŠÓÉĖ®µēĄė²śÉśµÄc(H+)=1”Į10-9mol”¤L-1£¬ŌņĻĀĮŠŠšŹöÕżČ·µÄŹĒ
A£®pHÖµŅ»¶ØĪŖ5 B£®Ņ»¶ØŹĒĖįČÜŅŗ
C£®æÉÄÜŹĒĒæĖįµÄĖįŹ½ŃĪČÜŅŗ D£®pHÖµæÉÄÜĪŖ9
²éæ““š°øŗĶ½āĪö>>
æĘÄæ£ŗøßÖŠ»Æѧ Ą“Ō“£ŗ2016½ģ½ĖÕŹ”ÄĻ¾©ŹŠĮłŠ£øßČżÉĻѧʌ12ŌĀĮŖæ¼»ÆѧŹŌ¾ķ£Ø½āĪö°ę£© ĢāŠĶ£ŗŃ”ŌńĢā
Ņ»¶ØĪĀ¶ČŹ±£¬ĻņČŻ»żĪŖ2LµÄĆܱÕČŻĘ÷ÖŠ³äČėŅ»¶ØĮæµÄSO2ŗĶO2£¬·¢Éś·“Ó¦£ŗ2SO2(g)+O2(g) 2SO3(g) ∆H£½?196kJ”¤moL?1£¬Ņ»¶ĪŹ±¼äŗó“ļĘ½ŗā£¬·“Ó¦¹ż³ĢÖŠ²ā¶ØµÄ²æ·ÖŹż¾Ż¼ūĻĀ±ķ£ŗ
2SO3(g) ∆H£½?196kJ”¤moL?1£¬Ņ»¶ĪŹ±¼äŗó“ļĘ½ŗā£¬·“Ó¦¹ż³ĢÖŠ²ā¶ØµÄ²æ·ÖŹż¾Ż¼ūĻĀ±ķ£ŗ
·“Ó¦Ź±¼ä/min | n(SO2)/mol | n(O2)/mol |
0 | 2 | 1 |
5 | 1.2 | |
10 | 0.4 | |
15 | 0.8 |
ĻĀĮŠĖµ·Ø²»ÕżČ·µÄŹĒ
A£®·“Ó¦ŌŚĒ°5minµÄĘ½¾łĖŁĀŹĪŖv (SO2)=0.08mol”¤L?1”¤min?1
B£®±£³ÖĪĀ¶Č²»±ä£¬ĻņĘ½ŗāŗóµÄČŻĘ÷ÖŠŌŁ³äČė0.2molSO2ŗĶ0.2mol SO3Ź±£¬v (Õż)£¾v (Äę)
C£®±£³ÖĘäĖūĢõ¼ž²»±ä£¬ČōĘšŹ¼Ź±ĻņČŻĘ÷ÖŠ³äČė2molSO3£¬“ļĘ½ŗāŹ±ĪüŹÕ78.4kJµÄČČĮæ
D£®ĻąĶ¬ĪĀ¶ČĻĀ£¬ĘšŹ¼Ź±ĻņČŻĘ÷ÖŠ³äČė1.5mol SO3£¬“ļĘ½ŗāŹ±SO3µÄ×Ŗ»ÆĀŹĪŖ40%
²éæ““š°øŗĶ½āĪö>>
æĘÄæ£ŗøßÖŠ»Æѧ Ą“Ō“£ŗ2016½ģÉĻŗ£ŹŠŹ®ČżŠ£øßČżÉĻѧʌµŚŅ»“ĪĮŖæ¼»ÆѧŹŌ¾ķ£Ø½āĪö°ę£© ĢāŠĶ£ŗŹµŃéĢā
ŃĒĮņĖįÄĘŗĶĮņ·ŪĶعż»ÆŗĻ·“Ó¦æÉÖʵĆĮņ“śĮņĖįÄĘ(Na2S2O3)”£
ŅŃÖŖ£ŗNa2S2O3ŌŚĖįŠŌČÜŅŗÖŠ²»ÄÜĪČ¶Ø“ęŌŚ”£ÓŠ¹ŲĪļÖŹµÄČܽā¶ČĖęĪĀ¶Č±ä»ÆĒśĻßČēÓŅĻĀĶ¼ĖłŹ¾”£Ä³ŃŠ¾æŠ”×éÉč¼ĘĮĖÖʱøNa2S2O3”¤5H2OµÄČēĻĀ×°ÖĆĶ¼ ”£

²æ·Ö²Ł×÷²½ÖčČēĻĀ£ŗ
¢Ł“ņæŖK1£¬¹Ų±ÕK2£¬ĻņŌ²µ×ÉÕĘæÖŠ¼ÓČė×ćĮæÅØĮņĖį£¬¼ÓČČ”£
¢ŚCÖŠ»ģŗĻŅŗ±»ĘųĮ÷½Į¶Æ£¬·“Ó¦Ņ»¶ĪŹ±¼äŗó£¬Įņ·ŪµÄĮæÖš½„¼õÉŁ”£
µ±CÖŠČÜŅŗµÄpH½Ó½ü7Ź±£¬¼“Ķ£Ö¹CÖŠµÄ·“Ó¦£¬Ķ£Ö¹¼ÓČČ
¢Ū¹żĀĖCÖŠµÄ»ģŗĻŅŗ£¬²¢½«ĀĖŅŗ½ųŠŠ“¦Ąķ£¬µĆµ½²śĘ·”£
31£®²½Öč¢ŁÖŠ£¬Ō²µ×ÉÕĘæÖŠ·¢Éś·“Ó¦µÄ»Æѧ·½³ĢŹ½ŹĒ ”£
32£®²½Öč¢ŚÖŠ£¬”°µ±CÖŠČÜŅŗµÄpH½Ó½ü7Ź±¼“Ķ£Ö¹CÖŠµÄ·“Ó¦”±µÄŌŅņŹĒ ”£”°Ķ£Ö¹CÖŠµÄ·“Ó¦”±µÄ²Ł×÷ŹĒ ”£
33£®²½Öč¢ŪÖŠ£¬”°¹żĀĖ”±ÓƵ½µÄ²£Į§ŅĒĘ÷ŹĒÉÕ±”¢ ”¢ (ĢīŅĒĘ÷Ćū³Ę)”£½«ĀĖŅŗ½ųŠŠ“¦Ąķ¹ż³ĢŹĒ½«ĀĖŅŗ¾¹ż ”¢ ”¢¹żĀĖ”¢Ļ“µÓ”¢ŗęøÉ£¬µĆµ½²śĘ·”£
ŅĄ¾Ż·“Ó¦2S2O32£ + I2 ”ś S4O62£ + 2I££¬æÉÓĆI2µÄ±ź×¼ČÜŅŗ²ā¶Ø²śĘ·µÄ“æ¶Č”£Č”5.5g²śĘ·ÅäÖĘ³É100mLČÜŅŗ”£Č”10mLČÜŅŗ£¬ŅŌµķ·ŪČÜŅŗĪŖÖøŹ¾¼Į£¬ÓĆÅضČĪŖ0.050 mol/L I2µÄ±ź×¼ČÜŅŗ½ųŠŠµĪ¶Ø£¬Ļą¹ŲŹż¾Ż¼ĒĀ¼ČēĻĀ±ķĖłŹ¾”£
±ąŗÅ | 1 | 2 | 3 | 4 |
ČÜŅŗµÄĢå»ż/mL | 10.00 | 10.00 | 10.00 | 10.00 |
ĻūŗÄI2±ź×¼ČÜŅŗµÄĢå»ż/mL | 19.99 | 19.98 | 17.13 | 20.03 |
34£®ÅŠ¶Ļ“ļµ½µĪ¶ØÖÕµćµÄĻÖĻóŹĒ ”£
35£®Na2S2O3”¤ 5H2OŌŚ²śĘ·ÖŠµÄÖŹĮæ·ÖŹżŹĒ ”£(¼ĘĖć½į¹ūĒėÓĆ°Ł·ÖŹż±ķŹ¾²¢±£Įō1Ī»Š”Źż)(Na2S2O3”¤ 5H2OµÄŹ½ĮæĪŖ248)
²éæ““š°øŗĶ½āĪö>>
æĘÄæ£ŗøßÖŠ»Æѧ Ą“Ō“£ŗ2016½ģĖÄ“ØŹ”øßČżÉĻѧʌ12ŌĀŌĀæ¼Ąķ×Ū»ÆѧŹŌ¾ķ£Ø½āĪö°ę£© ĢāŠĶ£ŗŃ”ŌńĢā
ÓŠ»śĪļAµÄ½į¹¹¼ņŹ½ČēĶ¼ĖłŹ¾£¬Ä³Ķ¬Ń§¶ŌĘäæÉÄܾßÓŠµÄ»ÆѧŠŌÖŹ½ųŠŠĮĖČēĻĀŌ¤²ā£¬ĘäÖŠÕżČ·µÄŹĒ( )
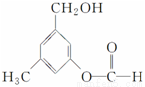
¢ŁæÉŅŌŹ¹ĖįŠŌøßĆĢĖį¼ŲČÜŅŗĶŹÉ«
¢ŚæÉŅŌŗĶNaOHČÜŅŗ·“Ó¦
¢ŪŌŚŅ»¶ØĢõ¼žĻĀæÉŅŌŗĶŅŅĖį·¢Éś·“Ó¦
¢ÜŌŚŅ»¶ØĢõ¼žĻĀæÉŅŌ·¢ÉśĻūČ„·“Ó¦
¢ŻŌŚŅ»¶ØĢõ¼žĻĀæÉŅŌŗĶŠĀÖĘCu(OH)2·“Ó¦
A£®¢Ł¢Ś¢Ū B£®¢Ł¢Ś¢Ū¢Ü C£®¢Ł¢Ś¢Ū¢Ż D£®¢Ł¢Ś¢Ü¢Ż
²éæ““š°øŗĶ½āĪö>>
æĘÄæ£ŗøßÖŠ»Æѧ Ą“Ō“£ŗ2016½ģÕć½Ź”øßČżÉĻѧʌµŚČż“ĪŌĀæ¼»ÆѧŹŌ¾ķ£Ø½āĪö°ę£© ĢāŠĶ£ŗŃ”ŌńĢā
æĘѧ¼Ņ×ī½üŃŠ¾æ³öŅ»ÖÖ»·±£”¢°²Č«µÄ“¢Ēā·½·Ø£¬ĘäŌĄķæɱķŹ¾ĪŖ£ŗNaHCO3+H2 HCOONa+H2O£¬ĻĀĮŠÓŠ¹ŲĖµ·ØÕżČ·µÄŹĒ
HCOONa+H2O£¬ĻĀĮŠÓŠ¹ŲĖµ·ØÕżČ·µÄŹĒ
A£®“¢Ēā¹ż³ĢÖŠ£¬NaHCO3±»Ńõ»Æ
B£®ŹĶĒā¹ż³ĢµÄ±¾ÖŹŹĒŃĪĄąµÄĖ®½ā
C£®“¢Ēā”¢ŹĶĒā¹ż³Ģ¾łĪŽÄÜĮæ±ä»Æ
D£®HCOONa¾§ĢåÖŠ¼Čŗ¬ÓŠĄė×Ó¼üÓÖŗ¬ÓŠ¹²¼Ū¼ü
²éæ““š°øŗĶ½āĪö>>
æĘÄæ£ŗøßÖŠ»Æѧ Ą“Ō“£ŗ2015-2016ѧğ°²»ÕŹ”ø߶žÉĻѧʌµŚČż“ĪŌĀæ¼»ÆѧŹŌ¾ķ£Ø½āĪö°ę£© ĢāŠĶ£ŗŃ”ŌńĢā
ĮŠ¹ŲÓŚ»ÆѧµēŌ“µÄŠšŹö“ķĪóµÄŹĒ
A£®Ē¦Šīµē³ŲÖŠø²øĒ×ÅPbO2µÄµē¼«°åŹĒøŗ¼«°å
B£®ĘÕĶØŠæĆĢøɵē³ŲÖŠĢ¼°ōĪŖÕż¼«
C£®ĒāŃõČ¼ĮĻµē³ŲµÄÕż¼«ŹĒĶØČėŃõĘųµÄÄĒŅ»¼«
D£®¼īŠŌŠæĆĢøɵē³ŲµÄ±ČÄÜĮæŗĶ“¢“ꏱ¼ä±ČĘÕĶØŠæĆĢøɵē³Ųøß
²éæ““š°øŗĶ½āĪö>>
æĘÄæ£ŗøßÖŠ»Æѧ Ą“Ō“£ŗ2015-2016ѧğø£½Ø³æźŲ”¢ĄäźŲ”¢ÕżźŲ”¢įŖ±õĖÄŠ£ø߶žÉĻĮŖæ¼»Æѧ¾ķ£Ø½āĪö°ę£© ĢāŠĶ£ŗŃ”ŌńĢā
ÓĆ0.01 mol”¤L£1NaOHČÜŅŗĶźČ«ÖŠŗĶpH£½3µÄĻĀĮŠČÜŅŗø÷100 mL£¬ŠčNaOHČÜŅŗĢå»ż×ī“óµÄŹĒ
A£®“×Ėį B£®ĮņĖį C£®ĻõĖį D£®ŃĪĖį
²éæ““š°øŗĶ½āĪö>>
æĘÄæ£ŗøßÖŠ»Æѧ Ą“Ō“£ŗ2016½ģŗÓ±±Ź”ÕżŅæŚŹŠĖÄŠ£øßČżÉĻѧʌĮŖæ¼»ÆѧŹŌ¾ķ£Ø½āĪö°ę£© ĢāŠĶ£ŗŃ”ŌńĢā
ĻĀĮŠÓŠ»ś·“Ó¦ÖŠ£¬²»ŹōÓŚČ”“ś·“Ó¦µÄŹĒ
A£®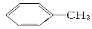 £«Cl2
£«Cl2
 £«HCl
£«HCl
B£®2CH3CH2OH£«O2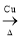 2CH3CHO£«2H2O
2CH3CHO£«2H2O
C£®ClCH2CH===CH2£« NaOH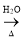 HOCH2CH===CH2£«NaCl
HOCH2CH===CH2£«NaCl
D£®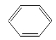 £«HO”ŖNO2
£«HO”ŖNO2
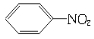 £«H2O
£«H2O
²éæ““š°øŗĶ½āĪö>>
°Ł¶ČÖĀŠÅ - Į·Ļ°²įĮŠ±ķ - ŹŌĢāĮŠ±ķ
ŗž±±Ź”»„ĮŖĶųĪ„·ØŗĶ²»Į¼ŠÅĻ¢¾Ł±ØĘ½ĢØ | ĶųÉĻÓŠŗ¦ŠÅĻ¢¾Ł±Ø×ØĒų | µēŠÅÕ©Ę¾Ł±Ø×ØĒų | É꥜Ź·ŠéĪŽÖ÷ŅåÓŠŗ¦ŠÅĻ¢¾Ł±Ø×ØĒų | ÉęĘóĒÖČؾŁ±Ø×ØĒų
Ī„·ØŗĶ²»Į¼ŠÅĻ¢¾Ł±Øµē»°£ŗ027-86699610 ¾Ł±ØÓŹĻä£ŗ58377363@163.com