
【题目】CO、H2是煤的气化产物,在生产生活中用途广泛。
(1)CO还原法处理大气污染物SO2
①2CO(g) + SO2(g) ![]() S(s)+2CO2(g) H = -270 kJ·mol-1,该反应的平衡常数表达式为__。
S(s)+2CO2(g) H = -270 kJ·mol-1,该反应的平衡常数表达式为__。
②在绝热恒容的密闭容器中进行上述反应,下列说法正确的是_____。
a 若混合气体密度保持不变,则已达平衡状态
b 达平衡后若再充人一定量CO2,平衡常数保持不变
c 分离出部分S,正、逆反应速率均保持不变,平衡不移动
d 从反应开始到平衡,容器内气体的压强保持不变
③向2 L恒温恒容密闭容器中通人2 mol CO、1 mol SO2,分别进行a、b、c三组实验。在不同催化剂件下发生反应:2CO(g) + SO2(g) ![]() S(s)+2CO2(g) H = -270 kJ·mol-1,反应体系总压随时间的变化如下表所示,则三组实验温度的大小关系是_____(用a、b、c表示),实验a从反应开始至45s达到平衡,则该过程反应速率v(SO2)__________(结果保留2位有效数字)。
S(s)+2CO2(g) H = -270 kJ·mol-1,反应体系总压随时间的变化如下表所示,则三组实验温度的大小关系是_____(用a、b、c表示),实验a从反应开始至45s达到平衡,则该过程反应速率v(SO2)__________(结果保留2位有效数字)。
| 0s | 40s | 45s | 60s |
a | 175 | 142 | 140 | 140 |
b | 160 | 120 | 120 | 120 |
c | 160 | 130 | 125 | 120 |
(2)利用CO、H2可制备天然气,主要反应为:
CO(g) + 3H2(g) ![]() CH4(g) + H2O(g) H1=-206.2 kJ·mol1;
CH4(g) + H2O(g) H1=-206.2 kJ·mol1;
CO(g) + H2O(g) ![]() CO2(g) + H2(g) H2 = -41.0 kJ·mol-1;
CO2(g) + H2(g) H2 = -41.0 kJ·mol-1;
H2O(l) ═H2O(g) H3 =+44 kJ·mol-1 。
回答下列问题:
①反应CO2(g) + 4H2(g) ![]() CH4(g) + 2H2O(l) 的H4 = ________ kJ·mol-1。某温度下,分别在起始容积相同的恒压容器A、恒容容器B中加人1molCO2和4molH2的混合气体,两容器反应达到平衡后放出或吸收的热量较多的是__( 填“A”或“B")。
CH4(g) + 2H2O(l) 的H4 = ________ kJ·mol-1。某温度下,分别在起始容积相同的恒压容器A、恒容容器B中加人1molCO2和4molH2的混合气体,两容器反应达到平衡后放出或吸收的热量较多的是__( 填“A”或“B")。
②在恒压管道反应器中按n(H2):n(CO) = 3:1通入原料气,在催化剂作用下制备合成天然气,400 ℃ p总为100 kPa时反应体系平衡组成如下表所示:
组分 | CH4 | H2O | H2 | CO2 | CO |
体积分数/% | 45.0 | 42.5 | 10.0 | 1.50 | 1.00 |
则该条件下CO的总转化率α=____。![]()
③制备合成天然气采用在原料气中通入水蒸气来缓解催化剂积碳。
积碳反应为:反应I :CH4(g) ![]() C(s) + 2H2(g) H = +75 kJ·mol-1;
C(s) + 2H2(g) H = +75 kJ·mol-1;
反应Ⅱ:2CO(g) ![]() C(s) + CO2(g) H = -172 kJ·mol-1,
C(s) + CO2(g) H = -172 kJ·mol-1,
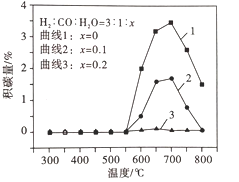
平衡体系中水蒸气浓度对积碳量的影响如图所示,下列说法正确的是__。
A 曲线1在700 ~ 800℃积碳量减小的原因可能是反应Ⅱ逆向移动
B 曲线1在550 ~700℃积碳量增大的原因可能是反应I、Ⅱ的速率增大
C 曲线2、3在550 ~800℃积碳量较低的原因是水蒸气稀释作用使积碳反应速率减小
D 水蒸气能吸收反应放出的热量,降低体系温度至550℃以下,有利于减少积碳
【答案】![]() a c a>b=c 0.0067 mol/(L·s) -253.2 A 97.9% AD
a c a>b=c 0.0067 mol/(L·s) -253.2 A 97.9% AD
【解析】
(1) ①平衡常数直接根据表达式得出答案;②气相为主的反应中,固相物质的浓度项不列入反应的平衡常数表达式,结合常用判断化学平衡的方法判断化学反应是否达到平衡,据此逐项分析;③理想气体状态方程PV=nRT,结合表格数据,可以比较出温度大小;计算反应速率,要计算出过程中SO2的消耗量即可。
(2) ①①CO(g) + 3H2(g) ![]() CH4(g) + H2O(g) H1=-206.2 kJ·mol-1;
CH4(g) + H2O(g) H1=-206.2 kJ·mol-1;
②CO(g) + H2O(g) ![]() CO2(g) + H2(g) H2 = -41.0 kJ·mol-1;
CO2(g) + H2(g) H2 = -41.0 kJ·mol-1;
③H2O(l) ═H2O(g) H3 =+44 kJ·mol-1 。
将方程式①-②-2x③得CO2(g) + 4H2(g) ![]() CH4(g) + 2H2O(l),△H进行相应的改变;A为恒温恒压、B为恒温恒容条件,如果是恒温恒容,反应前后物质的量减小、压强减小,开始时AB压强相等,B中压强逐渐减小A中压强不变,所以反应过程中压强A>B,增大压强平衡正向移动。
CH4(g) + 2H2O(l),△H进行相应的改变;A为恒温恒压、B为恒温恒容条件,如果是恒温恒容,反应前后物质的量减小、压强减小,开始时AB压强相等,B中压强逐渐减小A中压强不变,所以反应过程中压强A>B,增大压强平衡正向移动。
②设n(H2)=3mol、n(CO)=1mol,恒容恒温条件下气体的体积分数之比等于物质的量分数之比,设平衡时混合气体总物质的量为x mol,根据C原子守恒得![]() ,得x=2.11,则CO的转化率=
,得x=2.11,则CO的转化率=![]() ,该反应的正反应是放热反应,升高温度平衡逆向移动;
,该反应的正反应是放热反应,升高温度平衡逆向移动;
③A.反应II的逆反应是消碳反应;B.反应I、II的正反应都是积碳反应;C.高温条件下水蒸气和C反应生成CO和氢气;D.温度至550℃以下,几乎没有积碳。
(1) ①平衡常数表达式![]() ,故答案为:
,故答案为:![]() ;
;
②绝热恒容的密闭容器进行可以反应,
a. 混合气体密度为ρ=m/v,恒容容器容积V不变,反应前后气体的质量发生改变,则当反应到达平衡时,气体总质量m不变,因此若混合气体密度保持不变可以说明反应已经达到平衡状态,可知a正确;
b. 充人一定量CO2,反应移向移动,吸热,容器绝热,温度降低,平衡常数保持变化,b错误;
c.固体不影响平衡反应进行,故都不变,c正确;
d. 反应达到平衡前后,气体总物质的量发生改变,则体系压强改变,d错误;
ac正确,故答案为:a c;
③体系c和体系b反应起始时和平衡时的压强都相等,则二者平衡常数相同,体系c和体系b的温度相等,根据理想气体状态方程![]() ,初始时刻压强a>b,则实验温度a>b,因此三组实验温度的关系是a>b=c,故答案为:a>b=c;
,初始时刻压强a>b,则实验温度a>b,因此三组实验温度的关系是a>b=c,故答案为:a>b=c;
实验a从反应开始至平衡时,压强由175kPa改变至140kPa,设反应过程转化了xmol SO2,由理想气体状态方程可知,压强与气体总物质的量成正比,所以有![]() ,解得x=0.6mol,则反应速率
,解得x=0.6mol,则反应速率![]() ,故答案为:0.0067 mol/(L·s);
,故答案为:0.0067 mol/(L·s);
(2) ①①CO(g) + 3H2(g) ![]() CH4(g) + H2O(g) H1=-206.2 kJ·mol-1;
CH4(g) + H2O(g) H1=-206.2 kJ·mol-1;
②CO(g) + H2O(g) ![]() CO2(g) + H2(g) H2 = -41.0 kJ·mol-1;
CO2(g) + H2(g) H2 = -41.0 kJ·mol-1;
③H2O(l) ═H2O(g) H3 =+44 kJ·mol-1 。
将方程式①-②-2x③得CO2(g) + 4H2(g) ![]() CH4(g) + 2H2O(l),△H=-253.2 kJ·mol-1,;A为恒温恒压、B为恒温恒容条件,如果是恒温恒容,反应前后物质的量减小、压强减小,开始时AB压强相等,B中压强逐渐减小A中压强不变,所以反应过程中压强A>B,增大压强平衡正向移动,故答案为:-253.2;A;
CH4(g) + 2H2O(l),△H=-253.2 kJ·mol-1,;A为恒温恒压、B为恒温恒容条件,如果是恒温恒容,反应前后物质的量减小、压强减小,开始时AB压强相等,B中压强逐渐减小A中压强不变,所以反应过程中压强A>B,增大压强平衡正向移动,故答案为:-253.2;A;
②设n(H2)=3mol、n(CO)=1mol,恒容恒温条件下气体的体积分数之比等于物质的量分数之比,设平衡时混合气体总物质的量为x mol,根据C原子守恒得![]() ,得x=2.11,则CO的转化率=
,得x=2.11,则CO的转化率=![]() ,该反应的正反应是放热反应,升高温度平衡逆向移动;
,该反应的正反应是放热反应,升高温度平衡逆向移动;
③A.反应II的逆反应是消碳反应,曲线1在700-800℃积碳量减小的原因可能是反应Ⅱ逆向移动,且反应II的消碳量大于反应I的积碳量,故A正确;
B.反应I、II的正反应都是积碳反应,曲线1在550-700℃时两个反应没有达到平衡状态,都向正反应方向移动,导致积碳量增加,故B错误;
C.高温条件下水蒸气和C反应生成CO和氢气,从而使积碳量减少,故C错误;
D.温度至550℃以下,几乎没有积碳,所以水蒸气能吸收反应放出的热量,降低体系温度至550℃以下,有利于减少积碳,故D正确;
故选AD。


科目:高中化学 来源: 题型:
【题目】有一瓶无色溶液,可能含有![]() 、
、![]() 、
、![]() 、
、![]() 、
、![]() 、
、![]() 、
、![]() 、
、![]() 、
、![]() 离子中的几种.为确定其成分,进行如下实验:
离子中的几种.为确定其成分,进行如下实验:![]() 取少许溶液,逐渐加入过量的
取少许溶液,逐渐加入过量的![]() 固体,产生无色无味的气体和白色沉淀且白色沉淀逐渐增多后又部分溶解;
固体,产生无色无味的气体和白色沉淀且白色沉淀逐渐增多后又部分溶解;![]() 另取部分溶液,加入
另取部分溶液,加入![]() 酸化的
酸化的![]() 溶液,有白色沉淀产生;
溶液,有白色沉淀产生;![]() 用洁净的铂丝蘸取原溶液在酒精灯火焰上灼烧,观察到黄色火焰.下列推断正确的是
用洁净的铂丝蘸取原溶液在酒精灯火焰上灼烧,观察到黄色火焰.下列推断正确的是![]()
A.肯定有![]() 、
、![]() 、
、![]() 、
、![]()
B.肯定有![]() 、
、![]() 、
、![]() 、
、![]()
C.肯定没有![]() 、
、![]() 、
、![]()
D.肯定没有![]() 、
、![]() 、
、![]()
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】今有一混合物的水溶液,只可能含有以下离子中的若干种:![]() 、
、![]() 、
、![]() 、
、![]() 、
、![]() 、
、![]() 现取两份200mL溶液进行如下实验:①第一份加足量NaOH溶液,加热,收集到气体
现取两份200mL溶液进行如下实验:①第一份加足量NaOH溶液,加热,收集到气体![]() ;②第二份加足量
;②第二份加足量![]() 溶液后,得干燥沉淀
溶液后,得干燥沉淀![]() ,经足量盐酸洗涤、干燥后,沉淀质量为
,经足量盐酸洗涤、干燥后,沉淀质量为![]() 根据上述实验,以下推测正确的是
根据上述实验,以下推测正确的是![]()
A.一定不存在![]() ,
,![]() 可能存在
可能存在
B.![]() 一定存在,
一定存在,![]() 可能存在
可能存在
C.![]() 一定存在
一定存在
D.一定不存在![]()
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】由含碘废水制取碘酸钾的一种工艺如下:

(1)H2O2的结构式为___。“制I2”过程中加入的硫酸不能过多的原因是_____。
(2)制CuI(s)步骤反应的离子方程式为_________。
(3)工艺中五种物质的制备反应中,不涉及氧化还原反应的步骤是“制___”。
(4)“制KI(aq)”时,该温度下水的离子积为Kw=1.0×10-13,Ksp[Fe(OH)2]=9.0×10-15。为避免0.9 mol·L-1 FeI2溶液中Fe2+水解生成胶状物吸附I-,起始加入K2CO3必须保持溶液的pH不大于________。
(5)“制KIO3溶液”反应的离子方程式为______。
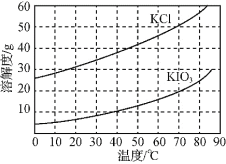
(6)KCl、KIO3的溶解度曲线如图所示。流程中由“KIO3(aq)”得到KIO3晶体的操作步骤为____。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】氢能源是最具应用前景的能源之一。
(1)氢氧燃料电池是一种高效无污染的清洁电池,用KOH溶液作电解质溶液,其负极反应式为_____________,理论上,正极消耗氧气2.8 L(标况下)时,电路中有__________mol e-通过。
(2)高纯氢的制备是目前的研究热点。可利用太阳能光伏电池电解水制高纯氢,工作示意图如下。通过控制双控开关,可交替得到H2和O2。
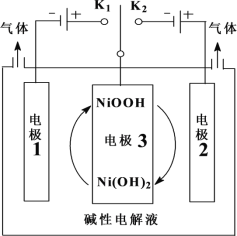
①太阳能光伏电池是将光能转化为__________能。
②当连接K1时可制得____________气体。
③当连接K2时,电极2附近pH_________(填“变大”、“变小”或“不变”)。
④当连接K2时,电极3作______极,其电极反应式为________________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】(1)已知:① C(s) + O2(g)=CO2(g) H=-393.5 kJmol-1
②2CO(g) + O2(g)=2CO2(g) H=-566 kJmol-1
③TiO2(s) + 2Cl2(g)=TiCl4(s) + O2(g) H=+141 kJmol-1
则TiO2(s) + 2Cl2(g) + 2C(s)=TiCl4(s) + 2CO(g)的H=_________________。
(2)氯化银在水中存在沉淀溶解平衡AgCl(s)![]() Ag+(aq) + Cl-(aq)。25℃时,氯化银的Ksp=1.8×10-10,现将足量的氯化银加入到0.1 molL-1氯化铝溶液中,银离子浓度最大可达到_____________molL-1。
Ag+(aq) + Cl-(aq)。25℃时,氯化银的Ksp=1.8×10-10,现将足量的氯化银加入到0.1 molL-1氯化铝溶液中,银离子浓度最大可达到_____________molL-1。
(3)20 ℃时,0.1 molL-1 NH4Al(SO4)2溶液的pH=3,则:2c(SO42-)-c(NH4+)-3c(Al3+)≈______________molL-1(填数值)。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】乙炔加氢是乙烯工业中的重要精制反应,利用这一反应可以将乙烯产品中的乙炔含量降低,以避免后续乙烯聚合催化剂的中毒,工业上称为碳二加氢过程。
已知:Ⅰ.CH![]() CH(g)+H2(g)→CH2=CH2(g) ΔH1 K1(400K)=4.2×1022
CH(g)+H2(g)→CH2=CH2(g) ΔH1 K1(400K)=4.2×1022
Ⅱ.CH![]() CH(g)+2H2(g)→CH3CH3(g) ΔH2=-311.4kJ·mol-1 K2(400K)=1.4×1038
CH(g)+2H2(g)→CH3CH3(g) ΔH2=-311.4kJ·mol-1 K2(400K)=1.4×1038
回答下列问题:
(1)已知几种化学键的键能如下表所示:
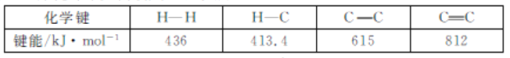
△H1=___kJmol-1。
(2)400K时,在密闭容器中将等物质的量的CH2=CH2(g)和H2(g)混合,采用适当的催化剂进行反应,生成CH3CH3(g),达到平衡时测得![]() =1016,则平衡时c(H2)=___molL-1。
=1016,则平衡时c(H2)=___molL-1。
(3)据前人研究发现乙炔在PV团簇表面催化加氢反应的部分历程如图1所示,其中吸附在PV表面上的物种用*标注。
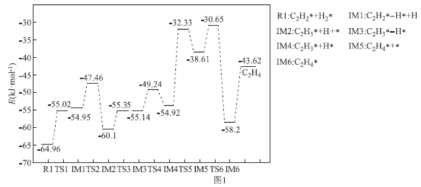
推测乙烯在PV表面上的吸附为___(填“放热”或“吸热”)过程。图1历程中最大能金(活化能)E正=___kJ·mol-1,该步骤的化学方程式为___。
(4)T1℃时,将体积比为1:2的CH≡CH(g)和H2(g)充入刚性密闭容器中,加入催化剂发生反应Ⅱ,起始体系总压强为P0 kPa,实验测得H2的分压(p)与反应时间(t)的关系如图2所示。
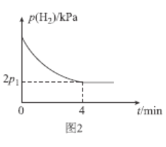
①T1℃时,0~4min内,平均反应速率v(HC≡CH)=___kPamin-1(用含p0、p1的代数式表示,下同)。
②T1℃时,该反应的化学平衡常数Kp=___kPa-2(Kp为以分压表示的平衡常数,分压=总压×物质的量分数)。
③T1℃时,0~2min内p(H2)的减小量___(填“>”“<”或“=”)2~4min内p(H2)的减小量,理由为___。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下图是某同学设计的验证原电池和电解池的实验装置,下列有关说法不正确的是( )
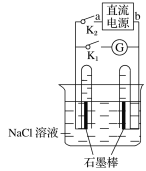
A. 关闭K2、打开K1,试管内两极都有气泡产生
B. 关闭K2、打开K1,一段时间后,发现左侧试管收集到的气体比右侧略多,则a为负极,b为正极
C. 关闭K2,打开K1,一段时间后,用拇指堵住试管移出烧杯,向试管内滴入酚酞,发现左侧试管内溶液变红色,则a为负极,b为正极
D. 关闭K2,打开K1,一段时间后,再关闭K1,打开K2,检流计指针不会偏转
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】在两个密闭容器中,分别充有质量相同的甲、乙两种气体,若两容器的温度和压强均相同,且甲的密度大于乙的密度,则下列说法正确的是
A.甲的相对分子质量比乙的相对分子质量小B.甲的摩尔体积比乙的摩尔体积小
C.甲的分子数比乙的分子数少D.甲中所含的原子数比乙中的所含的原子数少
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com