
����Ŀ��ijͬѧ���о�Ԫ�����ʵݱ����ʵ��ʱ���Լ������һ��ʵ�鷽��������¼���й�ʵ������(���±������е���ʵ�鷽��������ʵ��������ǰ��һ���Ƕ�Ӧ��ϵ)��
ʵ�鲽�� | ʵ������ |
����þ����ɰֽ��ĥ�����Թ��У���������ˮ������ˮ���ڣ�������Һ�еμӷ�̪��Һ | A.����ˮ���ϣ��۳�С���Ĵ��ζ���������˻˻��������֮��ʧ����Һ��ɺ�ɫ |
�������Ƶ�Na2S��Һ�еμ����Ƶ���ˮ | B.�������������Һ���dz��ɫ |
����һС������Ʒ�����з�̪��Һ����ˮ�� | C.���ҷ�Ӧ��Ѹ�ٲ���������ɫ���� |
����þ��Ͷ��ϡ������ | D.��Ӧ��ʮ�־��ң�������ɫ���� |
��������Ͷ��ϡ������ | E.���ɰ�ɫ��״�������̶�������ʧ |
����AlCl3��Һ�еμ�NaOH��Һ������ | F.���ɵ���ɫ���� |
���������ͬѧ���������ʵ�鱨�档
��1��ʵ��Ŀ�ģ��о�__________________Ԫ�����ʵݱ���ɡ�
��2��ʵ����Ʒ���Լ��������ơ�þ����������ϡ���ᡢ������ˮ������Na2S��Һ��AlCl3��Һ��NaOH��Һ����̪��Һ�ȡ�
������________��________����ֽ���ԹܼС���ͷ�ιܡ����ӡ��ձ���С��������Ƭ��ɰֽ�����ȡ�
��3��ʵ�����ݣ�(��д��ʵ�鲽���Ӧ��ʵ������ı�ź��٢��Ļ�ѧ����ʽ����ʵ��Ľ���)
ʵ������ | �� | �� | �� | �� | �� | �� |
ʵ������(��A��F) | ____ | ____ | __ | ____ | ____ | ____ |
��_________________________________________________��
��_____________________________________________��
��ʵ��Ľ��ۣ�________________________________________________________________��
���𰸡� ͬ���� �Թ� �ƾ��� B F A C D E Mg��2H2O![]() Mg(OH)2��H2�� Cl2��Na2S===S����2NaCl ����ԭ�������ĵ�����ͬ����Ԫ�ش����ҽ������������ǽ���������ǿ
Mg(OH)2��H2�� Cl2��Na2S===S����2NaCl ����ԭ�������ĵ�����ͬ����Ԫ�ش����ҽ������������ǽ���������ǿ
����������1������Ŀ��֪��ʵ��Ŀ��Ϊͬ����Ԫ�����ʵݱ���ɣ��ʴ�Ϊ��ͬ���ڣ���2���������ˮ���������ڣ�����Ҫ�ƾ��ƣ�������ˮ����ķ�Ӧ���Թ��н��У��ʴ�Ϊ���Թܡ��ƾ��ƣ���3����þ����ɰֽ��ĥ�����Թ��У���������ˮ������ˮ���ڣ�þ����ˮ��Ӧ���������������ݲ�������Ӧ����������þ����Һ�ʼ��ԣ�������Һ�еμӷ�̪��Һ����Һ�ʺ�ɫ��þ�������ã������������ᷢ���û���Ӧ����þ��Ͷ��ϡ�����У����ҷ�Ӧ��Ѹ�ٲ���������ɫ���壬������Ͷ��ϡ�����У���Ӧ��ʮ�־��ң�������ɫ���壻�����Ƶõ�Na2S��Һ���������Ƶ���ˮ��������Na2S����������ԭ��Ӧ����Ӧ�Ļ�ѧ����ʽΪNa2S+Cl2=2NaCl+S����һС������Ʒ�����з�̪��Һ����ˮ�У�����ˮ��Ӧ�����������ƺ���������ѧ����ʽ��2Na+2H2O=2NaOH+H2�����Դ˿ɵó��������ң�ͬ����Ԫ��ԭ�ӵ�ʧ���������ݼ����õ��������������ʴ�Ϊ��
ʵ������ | �� | �� | �� | �� | �� | �� |
ʵ������(��A��F) | B | F | A | C | D | E |
Na2S+Cl2=2NaCl+S����2Na+2H2O=2NaOH+H2����



| �꼶 | ���пγ� | �꼶 | ���пγ� |
| ��һ | ��һ��ѿγ��Ƽ��� | ��һ | ��һ��ѿγ��Ƽ��� |
| �߶� | �߶���ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
| ���� | ������ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ�����л�ѧ��Ӧ����������һ����������ԭ��Ӧ���� ( )
A.���Ϸ�ӦB.�ֽⷴӦ
C.���ֽⷴӦD.�û���Ӧ
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ�����������ھ�������������ˮ��������������ҵ���������������
��1���������������������ҿ������������е��ʷ�Ӧ���磺6Ag��s��+O3��g���T3Ag2O��s����H=��235.8kJ/mol��
��֪2Ag2O��s���T4Ag��s��+O2��g����H=+62.2kJ/mol��
�����·�Ӧ��2O3��g���T3O2��g���ġ�H= ��
��2����ѧ������ʹ�������������µ��ˮ�ķ����Ƶó�����������������Χ��ˮ�в������缫��ӦʽΪ3H2O��6e��=O3��+6H+ �� ���������ܽ���ˮ�е��������ɹ������⣬��缫��ӦʽΪ ��
��3��O3�ڼ��������¿ɽ�Na2SO4������Na2S2O8������������д���÷�Ӧ�Ļ�ѧ����ʽ��
��4�����õ�Na2S2O8��Һ�ɽ����л���Ⱦ��4��CP��ԭ����Na2S2O8��Һ��һ�������¿ɲ���ǿ���������ɻ���SO4������ͨ���ⶨ4��CP�����ʿ��ж�Na2S2O8��Һ����SO4��������ij�о�С�����ʵ��̽������Һ����ԡ�Fe2+��Ũ�ȶԲ���SO4����Ӱ�죮����Һ����Ե�Ӱ�죺����������ͬ����4��CP���뵽��ͬpH��Na2S2O8��Һ�У������ͼa��ʾ���ɴ˿�֪����Һ������ǿ����������ڡ������ڡ���Na2S2O8����SO4�� �� 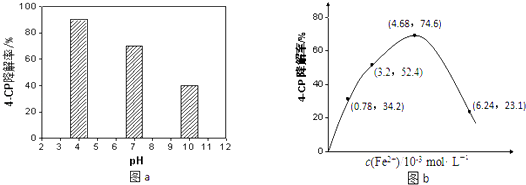
��Fe2+Ũ�ȵ�Ӱ�죺��ͬ�����£�����ͬŨ�ȵ�FeSO4��Һ�ֱ����c��4��CP��=1.56��10��4molL��1��c��Na2S2O8��=3.12��10��3 molL��1�Ļ����Һ�У���Ӧ240min����ʵ������ͼb��ʾ����֪ S2O82��+Fe2+�TSO4��+SO42��+Fe3+ �� ����ͼʾ��֪����˵����ȷ���ǣ�������ţ�
A����Ӧ��ʼһ��ʱ����4��CP��������Fe2+Ũ�ȵ����������ԭ����Fe2+��ʹNa2S2O8���������SO4����
B��Fe2+��4��CP���ⷴӦ�Ĵ���
C����c��Fe2+������ʱ��4��CP�����ʷ����½���ԭ�������Fe2+����SO4��������Ӧ�����IJ���SO4����
D��4��CP�����ʷ����½���ԭ����������ɵ�Fe3+ˮ��ʹ��Һ��������ǿ��������4��CP�Ľ��⣮
�۵�c��Fe2+��=3.2��10��3molL��1ʱ��4��CP�����ƽ����Ӧ���ʵļ������ʽΪ ��
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ��A��B��C��D��E��FΪԭ��������������Ķ���������Ԫ�أ�A��Fԭ�ӵ�����������������������������Fԭ�ӵĵ��Ӳ�����A��3����Bԭ�Ӻ�����ӷִ�3����ͬ�ܼ���ÿ���ܼ��ϵĵ�������ͬ��A��C�γɵķ���Ϊ�����Σ�Dԭ��p����ϳɶԵĵ�����������δ�ɶԵĵ���������Eԭ�Ӻ���ÿ��ԭ�ӹ���ϵĵ��Ӷ��ѳɶԣ�E�縺��С��F��
��1��A��C�γɵķ��Ӽ�������ˮ����÷��ӻ�Ϊ�ȵ������������Ϊ ��
��2���Ƚ�E��F�ĵ�һ�����ܣ�E�������������F��
��3��BD2�ڸ��¸�ѹ�����γɵľ�����ͼ��ʾ���þ������������������ӡ���ԭ�ӡ������ӡ������������壬�þ�����Bԭ�ӵ��ӻ���ʽΪ �� 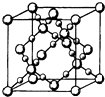
��4������F��ǿ����Һ��Ӧ��[F��OH��4]�����ɣ���[F��OH��4]���д���������ĸ���� a�����ۼ� b���Ǽ��Լ� c����λ�� d���Ҽ� e���м�
��5��Cu���������������壬�������ÿ����5��Cuԭ�ӽ��ܶ�������֪ÿ��Cuԭ�ӵ�����Ϊa g��Cuԭ�Ӱ뾶Ϊd cm����þ�����ܶ�Ϊgcm��3 �� ���ú�a��d�Ĵ���ʽ��ʾ��
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ����2L���ܱ������н������·�Ӧ��CO��g��+H2O��g��CO2��g��+H2��g�������������ݣ�
ʵ�� | �¶�/�� | ��ʼ��/mol | ƽ����/mol | |||
CO | H2O | CO2 | H2 | CO2 | ||
1 | 650 | 2.0 | 1.0 | 0 | 0 | 0.8 |
2 | 800 | 2.0 | 2.0 | 0 | 0 | 1.0 |
����˵����ȷ���ǣ� ��
A.����ӦΪ���ȷ�Ӧ
B.ʵ��1�У�CO��ת����Ϊ80%
C.650��ʱ����ѧƽ�ⳣ��K= ![]()
D.ʵ��1�ټ���1.0 mol H2O�����´ﵽƽ��ʱ��n��CO2��Ϊ1.6 mol
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ��A��B��C��D�������ʾ�Ϊ����������ɵĿ����Ի����������������ʵ����ӣ����Ӳ����ظ���ϣ��У�
������ | Na+��Al3+��Ba2+��NH4+ |
������ | Cl����OH����CO32����SO42�� |
�ֱ�ȡ�������ʽ���ʵ�飬ʵ��������
��B��Һ�ֱ���C��D��ϣ����а�ɫ�������ɣ�
�ڽ�A��Һ��ε���C��Һ�У��г������ɣ������μ�A��Һʱ����������ֱ����ȫ��ʧ��
��A��D���ֹ����ϼ������������ɣ���������ʹʪ��ĺ�ɫʯ����Һ������
����ʯī�缫���B��Һ���������ϲ���һ���д̼�����ζ�����壮
��1��A�����������ӵĵ���ʽ�� �� B�������������� ��
��2��C�Ļ�ѧʽ�� �� D�Ļ�ѧʽ�� ��
��3��д�����г����ܽ�����ӷ���ʽ ��
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ��������Ԫ��W��X��Y��Z��ԭ�������������ӡ�m��p��r������ЩԪ����ɵĶ�Ԫ�����n��Ԫ��Z�ĵ��ʣ�ͨ��Ϊ����ɫ���壬q��ˮ��Һ����Ư���ԣ� rΪһԪǿ�ᣬtͨ���ǹ�̬���ʡ��������ʵ�ת����ϵ��ͼ��ʾ������˵����ȷ���ǣ� ��
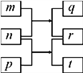
A. ԭ�Ӱ뾶�Ĵ�СW>X>Y
B. X���⻯�ﳣ�³�ѹ��ΪҺ̬
C. Ԫ�صķǽ�����Z>X>Y
D. Y������������ˮ����Ϊ����
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ������Ҫ����գ�
��1�������г��˼������ʣ��뽫���ʵĺ��������д�ڿո��ϣ� ͬλ�� �� ͬ�������� �� ͬ���칹�� �� ͬϵ�� ��
�ٽ��ʯ�롰����ϩ��C60����D��T����16O��17O��18O����������O2���������O3����
��  ��
�� 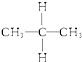 ���Ҵ���CH3CH2OH���ͼ��ѣ�CH3OCH3����
���Ҵ���CH3CH2OH���ͼ��ѣ�CH3OCH3����
�� ![]() ��
�� ![]() ����
���� ![]() ��
�� ![]() ��
��
��2��������ӷ���ʽ��MnO4��+C2O42��+=Mn2++CO2��+
��3�������� ![]()
��4��д��������״���CH3OH�������Ļ�ѧ����ʽ ��
��5������˿����KOH��Һ�����缫����������Ƭ�Ϸֱ�ͨ�������������γ�һ��ȼ�ϵ�أ�ͨ����IJ�˿Ϊԭ��ص����������ĵ缫��ӦΪ ��
��6��PET�ǵ��ڵ���Ҫ�ɷ֣�����������ƿ���Ŵ��ͽ�Ƭ��Ƭ���ȣ���ṹ��ʽ��ͼ�� ![]() ���ø߷��Ӳ����������ֵ���ͨ�����۷�Ӧ�Ʊ����ɣ��䵥��Ľṹ��ʽΪ�� ��
���ø߷��Ӳ����������ֵ���ͨ�����۷�Ӧ�Ʊ����ɣ��䵥��Ľṹ��ʽΪ�� ��
�鿴�𰸺ͽ���>>
����ʡ������Υ���Ͳ�����Ϣ�ٱ�ƽ̨ | �����к���Ϣ�ٱ�ר�� | ����թƭ�ٱ�ר�� | ����ʷ���������к���Ϣ�ٱ�ר�� | ������Ȩ�ٱ�ר��
Υ���Ͳ�����Ϣ�ٱ��绰��027-86699610 �ٱ����䣺58377363@163.com