
科目:高中化学 来源: 题型:
查看答案和解析>>
科目:高中化学 来源: 题型:
| 测定序号 | 待测溶液的体积(mL) | 所耗盐酸标准液的体积(mL) | |
| 滴定前读数 | 滴定后读数 | ||
| 1 | 20.00 | 0.50 | 20.78 |
| 2 | 20.00 | 1.20 | 21.32 |
查看答案和解析>>
科目:高中化学 来源: 题型:
查看答案和解析>>
科目:高中化学 来源: 题型:
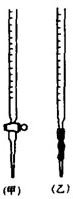 用中和滴定法测定某烧碱样品的纯度.有以下步骤:
用中和滴定法测定某烧碱样品的纯度.有以下步骤:| 测定序号 | 待测溶液的体积 /mL |
所耗盐酸标准液的体积/mL | |
| 滴定前 | 滴定后 | ||
| 1 | 20.00 | 0.50 | 20.78 |
| 2 | 20.00 | 1.20 | 21.32 |
查看答案和解析>>
科目:高中化学 来源:2014届广东省汕头市高二上学期期末理科化学试卷(解析版) 题型:实验题
用中和滴定法测定某烧碱样品的纯度。有以下步骤:
(1)配制待测液:用5.0g含有少量杂质(杂质不与盐酸反应)的固体烧碱样品配制1000mL溶液。除烧杯和玻棒外,还需要的玻璃仪器有___________________________.
(2)滴定:①盛装0.1000 mol/L的盐酸标准液应该使用_______式滴定管。
②滴定时双眼应_________________________________________________.
(3)有关数据记录如下:
|
测定序号 |
待测溶液的体积(mL) |
所耗盐酸标准液的体积(mL) |
|
|
滴定前读数 |
滴定后读数 |
||
|
1 |
20.00 |
0.50 |
20.78 |
|
2 |
20.00 |
1.20 |
21.32 |
计算纯度:烧碱样品的纯度是__________________;
(取两次实验所耗盐酸的平均值进行计算)
(4)误差讨论:(选填“偏高”、“偏低”或“无影响” )
① 用蒸馏水冲洗锥形瓶,会使测定结果____________;
② 在滴定过程中不慎将数滴酸液滴在锥形瓶外,会使测定结果____________;
③ 读数时,滴定前仰视,滴定后俯视,会使测定结果____________;
④ 装标准液之前,没有用标准液润洗滴定管,会使测定结果____________。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com