
今有如下三个热化学方程式:H2(g)+1/2O2(g)=H2O(g) ΔH=a kJ/mol、H2(g)+1/2O2(g)=H2O(l) ΔH=b kJ/mol 、2H2(g)+ O2(g)=2H2O(l) ΔH=c kJ/mol
关于它们的下列表述正确的是 ( )
A.它们都是吸热反应 B.a、b和c均为正值 C.a=b D.2b=c
 导学教程高中新课标系列答案
导学教程高中新课标系列答案 小学课时特训系列答案
小学课时特训系列答案科目:高中化学 来源: 题型:
0.5 mol H2 含有( )
0.5 mol 个氢气分子 B. 6.02×1023 个氢气分子
C. 3.01×1023 个氢气分子 D. 3.01×1023 个电子
查看答案和解析>>
科目:高中化学 来源: 题型:
某学生用下图所示的方法研究物质的性质,其中气体A的主要成分是氯气,杂质是空气和水蒸气。回答下列问题:
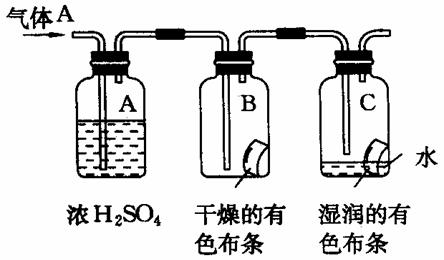
该项研究(实验)的主要目的是
(2)浓H2SO4的作用是 。
与研究目的直接相关的实验现象是
(3)从物质性质的方面来看,这样的实验设计还存在安全隐患,表
现是 。克服安全隐患的措施是(用化学方程式表示):
。
(4)若将剩余的氯气收集,测其在标准状况下的体积为11.2升,
让其与氢气充分化合,该反应的方程式为 ;
将生成的气体溶于水,配成500ml溶液,则该溶液中溶质的物质
的量浓度为 。
查看答案和解析>>
科目:高中化学 来源: 题型:
下列说法正确的是 ( )
A.增大压强,活化分子数增加,化学反应速率一定增大
B.缩小容器体积,活化分子百分数增加,化学反应速率一定增大
C.活化分子间所发生的分子间的碰撞为有效碰撞
D.加入反应物,使活化分子百分数增加,化学反应速率增大
查看答案和解析>>
科目:高中化学 来源: 题型:
已知热化学方程式: ①H2(g)+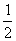 O2(g)==H2O(g) ΔH=-241.8 kJ·mol-1
O2(g)==H2O(g) ΔH=-241.8 kJ·mol-1
②2H2(g)+O2(g)===2H2O(g) ΔH=-483.6 kJ·mol-1
③H2(g)+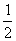 O2(g)===H2O(l) ΔH=-285.8 kJ·mol-1
O2(g)===H2O(l) ΔH=-285.8 kJ·mol-1
④2H2(g)+O2(g)===2H2O(l) ΔH=-571.6 kJ·mol-1则氢气的燃烧热为( )
A.241.8 kJ/mol B.483.6 kJ/mol
C.285.8 kJ/mol D.571.6 kJ/mol
查看答案和解析>>
科目:高中化学 来源: 题型:
可逆反应N2+3H2 2NH3的正、逆反应速率可用各反应物或生成物浓度的变化来表示。下列各关系中能说明反应已达到平衡状态的是( )
2NH3的正、逆反应速率可用各反应物或生成物浓度的变化来表示。下列各关系中能说明反应已达到平衡状态的是( )
A.3v正(N2)=v正(H2) B.v正(N2)=v逆(NH3)
C.2v正(H2)=3v逆(NH3) D.v正(N2)=3v逆(H2)
查看答案和解析>>
科目:高中化学 来源: 题型:
下列关于化学反应速率的说法正确的是( )
A.化学反应速率是指一定时间内任何一种反应物浓度的减少或任何一种生成物浓度的增加
B.化学反应速率为0.8 mol·(L·s)-1是指1 s时某物质的浓度为0.8 mol·L-1
C.根据化学反应速率的大小可以知道化学反应进行的快慢
D.对于任何化学反应来说,反应速率越大,反应现象就越明显
查看答案和解析>>
科目:高中化学 来源: 题型:
相同体积的pH=3的强酸溶液和弱酸溶液分别跟足量的镁完全反应,下列说法正确的是
A.弱酸溶液产生较多的氢气 B.强酸溶液产生较多的氢气
C.两者产生等量的氢气 D.无法比较两者产生氢气的量
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com