
分析 (1)pH=2的高碘酸溶液与pH=12的NaOH溶液中氢离子浓度和氢氧根离子的浓度相等,氢氧化钠是强碱,讨论高碘酸分别为强酸或弱酸,根据反应后溶液的酸碱性判断;
(2)由0.01mol/L的碘酸(HIO3)或高锰酸(HMnO4)溶液与pH=12的NaOH溶液等体积混合,所得溶液显中性,说明碘酸(HIO3)或高锰酸(HMnO4)都是强酸,0.01mol/L的碘酸(HIO3)溶液与pH=12的NaOH溶液等体积混合,两者恰好完全反应,生成碘酸钠,是强酸强碱盐,溶液呈中性,c(H+)=c(OH-),电荷守恒知,c(IO3-)+c(OH-)=c(H+)+c(Na+),所以液中IO3-与Na+的浓度相等.
解答 解:(1)pH=2的高碘酸溶液与pH=12的NaOH溶液中氢离子浓度和氢氧根离子的浓度相等,氢氧化钠是强碱,等体积混合时,若溶液呈中性,说明氢离子和氢氧根离子恰好反应,高碘酸是强酸,但实际上混合溶液呈酸性,这说明高碘酸又电离出部分氢离子,所以高碘酸是弱酸,
故答案为:弱酸;pH=2的高碘酸电离出的c(H+)和pH=12的NaOH溶液电离出的c(OH-)相等,且两者体积相等,但所得溶液显酸性,则高碘酸必定是不完全电离,所以高碘酸是弱酸;
(2)由0.01mol/L的碘酸(HIO3)或高锰酸(HMnO4)溶液与pH=12的NaOH溶液等体积混合,所得溶液显中性,说明碘酸(HIO3)或高锰酸(HMnO4)都是强酸,0.01mol/L的碘酸(HIO3)溶液与pH=12的NaOH溶液等体积混合,两者恰好完全反应,生成碘酸钠,是强酸强碱盐,溶液呈中性,c(H+)=c(OH-),电荷守恒知,c(IO3-)+c(OH-)=c(H+)+c(Na+),所以液中IO3-与Na+的浓度相等,
故答案为:等于.
点评 本题考查酸碱混合反应,题目难度中等,解答本题时注意判断酸碱溶液中氢离子和氢氧根离子的物质的量关系,根据反应后溶液的酸碱性判断,本题易错点为(2),注意电解质强弱的判断.


科目:高中化学 来源: 题型:选择题
| A. | 原电池反应一定是自发进行的氧化还原反应,且△H<0 | |
| B. | △H<0,△S<0的反应肯定能自发进行 | |
| C. | 体系能量增大和混乱度增大都有促使反应自发进行的倾向 | |
| D. | CaCO3(s)=CaO(s)+CO2(g)的△H>0,△S<0,该反应在较高温度下能自发进行 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 混合气体的密度不变 | B. | 容器中压强不变 | ||
| C. | 化学平衡常数K不变 | D. | 消耗1 molA的同时生成1molB |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 化学反应除了生成新物质外,还伴随着能量的变化 | |
| B. | 有的放热反应不需要加热就能发生 | |
| C. | 焓变就是反应热,二者没有区别 | |
| D. | 化学反应是放热还是吸热,取决于生成物具有的总能量和反应物具有的总能量 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 适量施用化学肥料和农药 | |
| B. | 大量开采地下水,以满足社会对水的需求 | |
| C. | 减少直至不使用对大气臭氧层起破坏作用的氟氯烃 | |
| D. | 采用“绿色化学”工艺,使原料尽可能转化为所需要的物质 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
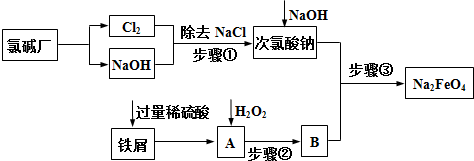
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com