
| A. | 溶解、过滤、加热(升华)、蒸发(结晶) | B. | 加热(升华)、溶解、过滤、蒸发(结晶) | ||
| C. | 升华、溶解、蒸馏、结晶 | D. | 溶解、结晶、过滤、升华 |
科目:高中化学 来源: 题型:选择题
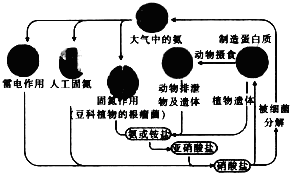
| A. | 含氮无机物和含氮有机物可相互转化 | |
| B. | 通过闪电产生NO属于高能固氮 | |
| C. | 硝酸盐被细菌分解为氮气过程氮元素一定被氧化 | |
| D. | C、H、O也参与自然界中氮循环 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 混合物 | B. | 有机物 | C. | 氧化物 | D. | 单质 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 16g O3含有的氧原子数为NA | |
| B. | 常温常压下,22.4L SO2含有的分子数为NA | |
| C. | 1molMg变成Mg2+时,失去电子的数目为NA | |
| D. | 1L 1mol•L-1H2SO4溶液中含H+的数目为NA |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
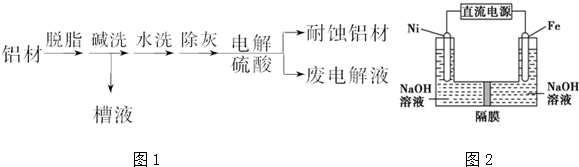
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| 步 骤 | 现象 |
| (1)其中e气体是有色的,其余气体均为无色,a、f是两种常见的大气污染物 | |
| (2)a和b在常温下混合 | 气体变红棕色 |
| (3)c和d混合 | 能产生白烟 |
| (4)b、e、f分别通入氢硫酸中 | 都产生淡黄色浑浊 |
| A. | NO、O2、NH3、HCl、Cl2、SO2 | B. | NO、O2、NH3、HCl、SO2、Cl2 | ||
| C. | NO、O2、NH3、CO2、NO2、SO2 | D. | O2、NH3、NO、HCl、Cl2、SO2 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
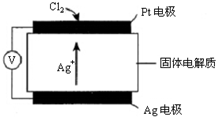 氯碱工业以电解精制饱和食盐水的方法制取氯气、氢气、烧碱,以及生产ClO2和氯的含氧酸盐(NaClO、NaClO3)等系列化工产品.
氯碱工业以电解精制饱和食盐水的方法制取氯气、氢气、烧碱,以及生产ClO2和氯的含氧酸盐(NaClO、NaClO3)等系列化工产品.查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 反应Ⅰ中S单质是氧化剂 | |
| B. | 反应ⅡAl2O3中Al元素被氧化 | |
| C. | 当生成5.4 g Al时,反应Ⅰ和反应Ⅱ共转移1.2 mol e- | |
| D. | 反应Ⅰ氧化产物与还原产物物质的量之比为2:9 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com